. 6. januára 2023; 24(2):1171. DOI: 10.3390/ijms24021171
Abstraktný
Zápalové poruchy, ako je ateroskleróza, cukrovka a reumatoidná artritída, sú regulované cytokínmi a inými zápalovými mediátormi. Súčasná liečba týchto stavov je spojená s významnými vedľajšími účinkami a úplne nepotláča zápal. Výhody stravy, najmä úloha konkrétnych zložiek, sú zle pochopené. Polynenasýtené mastné kyseliny (PUFA) majú niekoľko priaznivých účinkov na zdravie. Väčšina štúdií o PUFA bola na omega-3 mastných kyselinách. Tento prehľad sa zameria na menej študovanú mastnú kyselinu, kyselinu pinolénovú (PNLA) z píniových orieškov, ktorá zvyčajne tvorí až 20 % jej celkových mastných kyselín. PNLA sa objavuje ako diétna PUFA a sľubný doplnok v prevencii zápalových porúch alebo ako alternatívna liečba. Niektoré štúdie preukázali zdravotné dôsledky oleja z píniových orieškov (PNO) a PNLA na zníženie hmotnosti, zníženie lipidov a antidiabetické účinky, ako aj na potlačenie invazívnosti a pohyblivosti buniek pri rakovine. Len málo recenzií sa však konkrétne zameralo na biologické a protizápalové účinky PNLA. Okrem toho v nedávnych bioinformatických štúdiách na ľudských vzorkách bola expresia mnohých mRNA a mikroRNA regulovaná PNLA, čo naznačuje potenciálnu transkripčnú a posttranskripčnú reguláciu zápalových a metabolických procesov. Cieľom tohto prehľadu je zhrnúť, zdôrazniť a vyhodnotiť výsledky výskumu PNO a PNLA vo vzťahu k potenciálnym protizápalovým prínosom a prospešným metabolickým zmenám. V tejto súvislosti sa prehľad zameriava na potenciálne účinky PNLA na zápal spolu s moduláciou metabolizmu lipidov a oxidačného stresu na základe údajov z experimentov in vitro aj in vivo a zistení na ľuďoch, vrátane analýzy génovej expresie.
1. Úvod
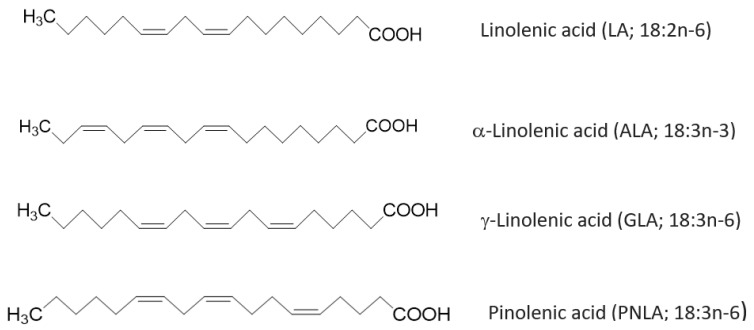
Mastné kyseliny (FA) sú v životnom prostredí rozšírené a sú hlavnými zložkami triacylglycerolov (TAG), fosfolipidov (PL) a ďalších lipidových zlúčenín [1]. Sú dôležité v biologických a metabolických funkciách, pretože sú kľúčovými zložkami bunkových organel. Zloženie FA bunkovej membrány je ovplyvnené genetikou, stravou, metabolizmom a hormónmi [1]. Fyzikálne a funkčné vlastnosti bunkových membrán vrátane signalizácie a prevádzky v rámci membrány sú ovplyvnené množstvom FA prítomných v membráne. Polynenasýtené FA (PUFA) sú široko prítomné v rastlinách a morských zdrojoch. Doteraz, keď sa preukázalo, že mnohé FA rastlinného pôvodu majú zápalové potláčacie účinky [1], by to mohla byť dobrá alternatíva k FA morských zdrojov so zmenšujúcimi sa populáciami rýb. Preto je potrebné preskúmať udržateľnejšie zdroje FA podporujúcich zdravie. Kyselina pinolénová (PNLA) ako FA rastlinného pôvodu teda môže byť kandidátom a v posledných rokoch sa stala populárnou vďaka svojej schopnosti potláčať chuť do jedla a znižovať hmotnosť [2]. PNLA je Δ5-nenasýtený polymetylénom prerušený FA (UPIFA) (obrázok 1). Jeho štruktúra je analogická so štruktúrou kyseliny linolovej (LA) (prekurzor kyseliny n-6 a γ-linolénovej (GLA)); GLA (prekurzor kyseliny n-6 a dihomo-γ-linolénovej (DGLA)) a kyselina α-linolénová (ALA; n-3 a pôvodca kyseliny dokosahexaénovej (DHA) a kyseliny eikosapentaénovej (EPA)) [3] (obrázok 1).
Obrázok 1.
Niektoré PUFA, ako napríklad PNLA, sú príkladmi nutraceutík, o ktorých sa predpokladá, že majú protizápalové účinky prostredníctvom intracelulárnych signálov, ktoré aktivujú protizápalové dráhy, ako sú receptory aktivované peroxizómovým proliferátorom (PPAR) [4,5,6] a potláčajú prozápalové dráhy/mediátory, ako je nukleárny faktor kappa-zosilňovač ľahkého reťazca aktivovaných B buniek (NF-κB) [5,6], eikosanoidy odvodené od kyseliny arachidónovej (AA) a tvorba reaktívnych foriem kyslíka (ROS) so všeobecne vynikajúcim bezpečnostným profilom [3,4,5,6]. Amr a Abeer ukázali, že olej z píniových orieškov (PNO) má široký terapeutický účinok, ako je antibakteriálny, protiplesňový, antivírusový, antiseptický, expektoračný, cholagog, choleretický, diuretický a antihypertenzívny [7]. V štúdiách na ľuďoch sa preukázalo, že PNLA má protizápalové, imunitne metabolické, antireumatické a antiaterogénne účinky [5,6] spolu s vlastnosťami znižujúcimi hmotnosť [2]. Podľa mnohých štúdií majú PNO a PNLA potenciál na použitie ako anticholesterické látky [3,7,8]. V tomto prehľade zhrnieme dôkazy, ktoré naznačujú, že PNLA môže pôsobiť ako protizápalové činidlo.
2. Composition of PNLA and Pine Nuts Oils
Spotreba píniových orieškov a PNO sa za posledných niekoľko desaťročí zvýšila. Najväčší distribútori sú v Ázii vrátane Číny, Severnej Kórey a Pakistanu. Kórea, USA a Rusko sú najväčšími užívateľmi píniových orieškov a PNO [9]. Píniové oriešky majú jedinečnú chuť s veľmi vysokým obsahom kalórií a lipidov. Píniové oriešky sa skladajú z takmer 64 % tuku, 20 % bielkovín a 5 % sacharidov [10,11]. Väčšina FA v píniových orieškoch sú nenasýtené FA (UFA) s iba 10% nasýtených FA (SFA) [12]. Píniové oriešky sú dlhé 9–12 mm [13] a majú vysoký obsah oleja (45–65 g/100 g orechov) [12,13]. PNLA je nezvyčajná a jedinečná PUFA, ktorá sa nachádza iba v PNO, ako je Pinus orientalis a semená prímorskej borovice (P. pinaster), ktoré sú bohatým zdrojom PNLA [9,13]. Píniové oriešky z P. koraiensis (kórejská borovica), P. sibirica (sibírska borovica), P. gerardiana (borovica chilgoza) a P. pinea (borovica kamenná) sú najbežnejšími rodmi, ktoré konzumujú spotrebitelia [9]. Orechové oleje z P. eldarica, P. excelsa, P. pinea a P. torreyana majú nízku hladinu PNLA (v prípade P. pinea veľmi nízku) a sú bohaté na LA alebo kyselinu olejovú [14]. PNO obsahuje aj antioxidačné zložky rozpustné v lipidoch, vrátane tokoferolov, fytosterolov a skvalénu.
Zloženie FA píniových orieškov (oleje P. sibirica a P. koraiensis) bolo definované a zistilo sa, že LA (all-cis-9-, -12–18:2) je hlavnou a najhojnejšou PUFA (48,4 %) v PNO. Kyselina olejová (cis-9-18:1) je druhým najbežnejším mononenasýteným FA (MUFA) (24 %). PNLA je najbežnejšia UPIFA, zvyčajne obsahuje približne 15 až 20 % celkových FA a kyselina taxolová predstavuje asi 1,8 % [3]. Dva hlavné SFA v PNO sú kyselina palmitová (16:0) a kyselina stearová (18:0). Kórejské píniové oriešky (KPN) a sibírske píniové oriešky (SPN) sú bohatým zdrojom PNLA, ktorý tvorí až 20 % a 27 % ich celkového obsahu.
3. PNLA a jej metabolizmus
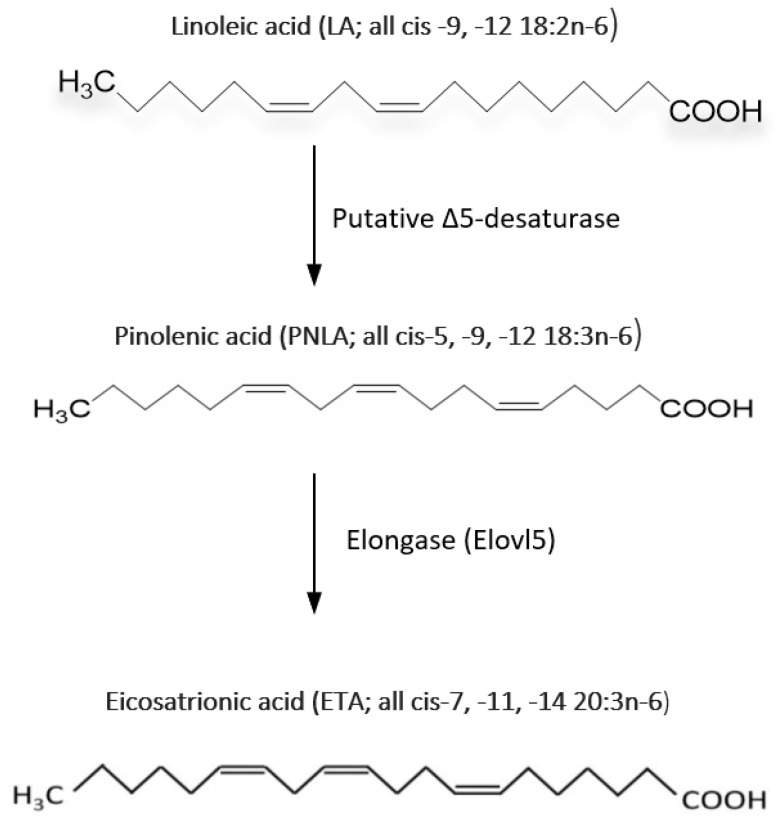
V systémoch cicavcov nebol metabolizmus PNLA dobre preskúmaný. Uvádza sa, že PNLA sa nekonvertuje na AA, ale môže znížiť hladiny AA vo frakcii fosfatidylinozitolu buniek HepG2 zo 16 % na 8,7 % [15]. PNLA sa rýchlo začleňuje, metabolizuje a predlžuje na kyselinu Δ-7 eikosatriénovú (7 ETA; všetky cis-7, -11, -14-20:3) systémom predĺženia FA. Po liečbe PNLA sa vysoký podiel (až 30 %) ETA nachádza v rôznych bunkových membránach PL [16,17,18,19,20,21,22]. Malá časť tohto predĺženého metabolitu sa ďalej predĺži za vzniku formy (cis-9,-13,-16–22:3). Množstvo PNLA a jej metabolitov, ktoré sú začlenené do bunkovej membrány, je ovplyvnené koncentráciou PNLA a trvaním inkubácie [17,19,20]. Napríklad hladina formy Δ-9,-13,-16–22:3 v makrofágoch RAW264,7 sa zvyšovala so zvyšujúcim sa množstvom PNLA v kultivačnom médiu a inkubačným časom [16]. PNLA zmenila zloženie FA v PL v myších makrofágoch RAW264.7 so znížením hladín 18- a 20-uhlíkových PUFA a zvýšením 22-uhlíkových FA [16]. To znamená, že hladiny SFA klesajú, zatiaľ čo UFA sa zvyšuje v PL frakcii; to môže byť jeden z dôvodov protizápalových účinkov PNLA. Obrázok 2 ukazuje metabolickú dráhu PNLA.
Obrázok 2.
Elongáza 5, enzým kódovaný génom Elongáza veľmi dlhých mastných kyselín 5 (ELOVL5), predlžuje mono- a polynenasýtené FA s dĺžkou 18–20 uhlíkov. Elongáza 5 katalyzuje cyklus predlžovania FA s dlhým reťazcom a je počiatočným krokom a krokom obmedzujúcim rýchlosť. Je tiež zodpovedný za predĺženie PNLA, ako sa nedávno ukázalo a ukázalo [20]. Väčšina protizápalových účinkov, ako je zníženie tvorby zápalových mediátorov, vrátane interleukínu (IL)-1β, IL-6, faktora nekrózy nádoru (TNF)-α a prostaglandínu (PG)E2, v EA. endotelová bunková línia hy296 po inkubácii PNLA bola oslabená umlčaním elongázy 5, čo naznačuje, že PNLA pôsobí prostredníctvom produktu predlžovania [20].
Tanaka a kol. v roku 2007 študovali metabolickú dráhu niektorých PUFA odvodených z ihličnatého oleja (kyselina sciadonová a kyselina borievcová), ktoré boli metabolizované na esenciálne FA v živočíšnych bunkách; nahromadená LA bola predĺžená v mikrozómoch pečene potkanov a predpokladalo sa, že kyselina sciadonová prešla β-oxidačnou cestou [23]. Podobne štúdie in vitro založené na mikrozómoch pečene potkanov zistili C2-predĺžený metabolit PNLA, hoci sa nenašiel v experimentoch in vivo [18]. Potenciálnym dôvodom týchto kontrastných pozorovaní je, že in vivo môže byť C2-predĺžený metabolit PNLA rýchlo translokovaný do mitochondrií a podliehať β-oxidácii. Väčšina diétnych linoleátov a K-linolenátov u potkanov bola β-oxidovaná, pričom iba 3,0 % a 1,4 % sa premenilo na dlhšie PUFA [18]. Pretože PNLA je substrátom karnitín-palmitoyltransferázy I ako K-linolenátu, prakticky všetka PNLA v oleji z borovicových semien (PSO) bola oxidovaná mitochondriálnou β-oxidačnou cestou, preto sa C2 reťazcom predĺžený metabolit PNLA pravdepodobne nemusí dostať na úroveň pozorovanú v experimentoch in vitro [18].
4. PNO a PNLA inhibujú zápalovú reakciu
Protizápalové účinky PNO boli preukázané na zvieracích modeloch in vitro a in vivo [3,4,10,24], ktoré boli preukázané aj pri PNLA [5,6,15,16,17,19,25]. Diétne PUFA ovplyvňujú zápal niekoľkými mechanizmami, vrátane zmeny funkcie a štruktúry membrány a regulácie syntézy lipidových mediátorov [1,26]. Nedávno Takala a kol. ukázali, že protizápalové účinky PNLA sú spojené so zmenami v génovej expresii a intracelulárnych signalizačných sieťach [5,6], pričom potlačenie NF-κB [5,6,20,26] a prevodník signálu a aktivátor transkripcie (STAT) sú kľúčovými potenciálnymi mechanizmami [5,6]. Takéto transkripčné faktory by mohli potenciálne regulovať enzýmy vrátane cyklooxygenázy-2 (COX-2) a indukovateľnej syntázy oxidu dusnatého (iNOS), ako aj prozápalových cytokínov, ako sú TNF-α a IL-6. Okrem toho bioinformatická analýza [5] naznačila, že by sa stimulovali protizápalové transkripčné faktory vrátane PPAR [4,5,6,27,28] a jeho koaktivátora PPAR-koaktivátora 1-alfa (PGC-1α). PGC-1α je produktom génu PPARGC1A. PPAR inhibuje NF-κB, STAT1, aktivačný proteín 1 (AP-1) a STAT3. Okrem toho PNO a PNLA inhibujú produkciu NO [3,17], PGE2 [5,16,17] a prozápalových cytokínov [3,5,17,19]. Celkové protizápalové účinky PNLA a PNO sú zhrnuté v tabuľke 1.
Tabuľka 1.
Súhrn protizápalových účinkov oleja z píniových orieškov (PNO) alebo kyseliny pinolénovej (PNLA).
| Model | PNO alebo PNLA | Experimentálny dizajn | Výsledky a výsledky liečby PNO a PNLA | Referencie |
|---|---|---|---|---|
| Myšie RAW264.7 makrofágy | PNLA | 10, 25, 50 alebo 100 μM PNLA počas 24 hodín, po ktorej nasleduje stimulácia lipopolysacharidmi (LPS) (100 ng/ml) počas 16 h.50 μM PNLA počas 24 hodín, po ktorej nasleduje stimulácia LPS (100 ng/ml) počas 16 hodín. | Uvoľňovanie PGE1 bunkami RAW264.7 je znížené o 10, 25, 50 a 100 μM PNLA o 33, 49, 73 a 84 %. COX-2 nie je ovplyvnený 50 μM PNLA. | [16] |
| Ľudské bunky rakoviny prsníka MDA-MB-231 | PNLA | 50 alebo 100 μM PNLA počas 24 hodín, po ktorej nasleduje stimulácia 12-O-tetradekanoylforbol-13-acetátom (TPA) (100 ng/ml) počas 12 h.100 μM PNLA počas 24 hodín, po ktorej nasleduje stimulácia TPA (0,1 μg/ml) počas 12 hodín. | Uvoľňovanie PGE2 je znížené o 50 a 75 % o 50 a 100 μM PNLA. COX-2 mRNA a proteín sú znížené asi o 55% o 100 μM PNLA. | [22] |
| Myšie makrofágové bunky RAW264.7 a primárne peritoneálne makrofágy potkanov | PNLA | 25, 50 a 100 μM PNLA počas 24 hodín, po ktorej nasleduje stimulácia LPS (100 ng/ml) počas 16 hodín a 100 μM PNLA počas 24 hodín, po ktorej nasleduje stimulácia LPS (0,1 μg/ml) počas 8 hodín a 100 uM PNLA počas 24 hodín, po ktorej nasleduje stimulácia LPS (100 ng/ml) počas 30 min.50 a 100 μM PNLA počas 24 hodín, po ktorej nasleduje stimulácia LPS (100 ng/ml) počas 15 minút. | Uvoľňovanie PGE2 bunkami RAW264.7 pri 50 a 100 μM PNLA je znížené o 67 % a 80 %. Uvoľňovanie PGE2 perineálnymi makrofágmi je znížené o 13 % o 50 μM PNLA, ale nie je ovplyvnené 25 μM PNLA. COX-2 v bunkách RAW264.7 je znížený o 50 a 100 μM PNLA o 20 a 40 %. Pomer proteínu NF-κB/p65 v bunkách RAW264.7 ošetrených 50 a 100 μM PNLA je znížený o 40 a 50 %. | [29] |
| Myšie mikrogliálne bunky BV-2 a primárne peritoneálne makrofágy potkanov | PNLA | 50 μM PNLA počas 24 hodín, po ktorej nasleduje stimulácia LPS (100 ng/ml) počas 16 hodín. | Uvoľňovanie IL-6, TNF-α, NO a PGE2 bunkami BV-2 je znížené o 71, 27, 41 a 89%. V bunkách BV-2 je expresia proteínov iNOS a COX-2 znížená o 53 %, respektíve 10%. Produkcia NO a PGE2 peritoneálnymi makrofágmi je znížená o 31 %, respektíve 35 %. | [17] |
| THP-1 macrophages | PNLA | 10, 25, 50 and 100 μM PNLA for 24 h followed by LPS stimulation (200 ng/mL) for 16 h. | Release of TNF-α is reduced by 9 and 18%, respectively by 50 and 100 μM PNLA. IL-6 is reduced by 9, 24, 33 and 48% by 10, 25, 50 and 100 μM PNLA, respectively. PGE2 is reduced by 55, 67, 78, and 83%, respectively by 10, 25, 50 and 100 μM PNLA. Protein expression of COX-2 is reduced by 50 and 100 μM PNLA by 20 and 25%, respectively. | [19] |
| Hep G2 cells | PNLA | 25 μM PNLA for 12 h followed by 0.5 mM oleic acid for 24h. | Synthesis of NO by HepG2 cells is reduced by 60% with 25 μM PNLA. | [25] |
| Bunky EA. hy296 | PNLA | 10, 25 a 50 μM PNLA počas 48 hodín, po ktorej nasleduje stimulácia TNF-α (1 ng/ml) počas 24 hodín, 50 μM PNLA počas 48 hodín, po ktorej nasleduje stimulácia TNF-α (1 ng/ml) počas 1 h.25 a 50 μM PNLA počas 48 hodín, po ktorej nasleduje stimulácia TNF-α (1 ng/ml) počas 6 hodín. | Hladiny rozpustnej medzibunkovej adhéznej molekuly (ICAM)-1 o 10, 25 a 50 μM PNLA sa znížia o 15, 23 a 24 %. Uvoľňovanie monocytového chemotaktického proteínu (MCP)-1 je znížené pri 50 μM PNLA o 25%. Produkcia regulovaných aktivácií, normálnych exprimovaných a vylučovaných T buniek (RANTES) je znížená o 46 % s 50 μM PNLA. Pomer proteínov fosforylovaný-NFκB/NFκB je znížený o 50%. Adherencia buniek THP-1 k bunkovým monovrstvám EA.hy296 je znížená o 25 % pri 50 μM PNLA. | [20,27] |
| THP-1 monocyty, PMA-diferencované THP-1 makrofágy a ľudské monocyty odvodené od makrofágov (HMDM). | PNLA | 25, 50, 75 a 100 μM PNLA počas 24 hodín, po ktorej nasleduje stimulácia 20 ng/ml MCP-1 počas 3 hodín pri migrácii monocytov a inkubácia Lucifer Yellow (LY) a oxidovaná LDL (ox-LDL) počas 24 hodín pre makropinocytózu a vychytávanie Dil-ox-LDL, v uvedenom poradí pre makrofágy THP-1 a HMDM. | Priemerný pokles migrácie monocytov THP-1 sprostredkovanej MCP-1 vo všetkých koncentráciách PNLA bol 55 %. Makropinocytóza a vychytávanie DiI-ox-LDL sa znížilo o 50 % a 40 % v makrofágoch THP-1 a o 40 % a 25 % v HMDM. | [5] |
| Mononukleárne bunky periférnej krvi (PBMC) od zdravých kontrol (HC) a pacientov s reumatoidnou artritídou (RA). | PNLA | 25 a 50 μM PNLA počas 24 hodín, po ktorých nasleduje stimulácia LPS (100 ng /ml) počas 16 hodín. | Hladiny TNF-α a IL-6 v voľných supernatantoch sa znížili o 60 % u pacientov s RA a u HC o 50 a 35 % o 25 a 50 μM PNLA. PGE2 bol znížený o 50 % u pacientov s HC aj RA o 50 μM PNLA. | [5] |
| CD14 monocyty purifikované od pacientov s RA s aktívnym ochorením. | PNLA | 25 a 50 μM PNLA počas 24 hodín, po ktorých nasledovala stimulácia LPS (0,1 μg /ml) počas 9 hodín. Podiely monocytotov CD14 alebo monocytov CD14 exprimujúcich TNF-α, IL-6, IL-1β a IL-8 v purifikovaných monocytoch boli hodnotené prietokovou cytometriou. | Percento monocytov exprimujúcich TNF-α, IL-6 a IL-1 sa znížilo o 23 %, 25 % a 23 % PNLA. Percento monocytov CD14+ sa znížilo o 20 % po 25 alebo 50 μM PNLA. | [6] |
| Male Wistar rats | PNO (P. sibirica) | 300 mg/kg bodyweight PNO for 2 days and 4 h prior to carrageenan injection into right feet and exposing the feet to a heat of 55 °C. | Swelling (paw volume) at 3-, 12- and 24 h following carrageenan injection was reduced by 24, 36 and 45%, respectively. Fever-reducing effect (surface temperature of adjuvant-inflamed paw) was reduced by 5%, 10% and 10%, respectively following 3, 12 and 24 h after carrageenan injection. Analgesic effect (response time to 55 °C thermal-induced hot-plate) was induced by more than 100% following 3 and 12 h while unaffected following 24 h. | [24] |
| Samce myší ICR | PNLA | PNLA (3 g) sa podávala intradermálne do uší počas 18 hodín, po ktorej nasledovala TPA (5 g) počas 6 alebo 24 hodín. | Opuch ucha, hrúbka a expresia proteínu COX-2 v homogenátoch ušného tkaniva myší sa znížili o 29, 15 a 53 %. Infiltrácia leukocytov (CD45+), neutrofilov (Ly6G+CD45+) a makrofágov (F4/80+CD45+) bola znížená o 63, 50 % a 70 %. Hladiny IL-1, IL-6, TNF-α a PGE2 v supernatante bez buniek dorzálnej kože boli znížené o 79, 68, 42 a 51 %. Expresia fosforylovaného p38 bola dorzálne kožné tkanivo znížené o 55%. | [19] |
COX, cyklooxygenáza; Dil-ox-LDL, DiI-značený oxidovaný lipoproteín s nízkou hustotou; ERK, extracelulárnym signálom regulovaná kináza; HMDM, makrofágy odvodené z ľudských monocytov; HC, zdravé kontroly; hodina, h; ICAM, medzibunková adhézna molekula; IL, interleukín; iNOS, indukovateľná syntáza oxidu dusnatého; JNK, c-Jun N-terminálna kináza; LPS, lipopolysacharid; LY, Lucifer žltá; MCP, monocytový chemotaktický proteín; NF-κB, nukleárny faktor kappa-zosilňovač ľahkého reťazca aktivovaných B buniek; NIE, oxid dusnatý; PGE2, prostaglandín E2; PBMC, mononukleárne bunky periférnej krvi; PNLA, kyselina pinolénová; PMA, forbol 12-myristate 13-acetát; RA, reumatoidná artritída; RANTES, regulované aktiváciou normálnych T buniek exprimovaných a vylučovaných; TNF, faktor nekrózy nádorov; TPA, 12-O-tetradekanoylforbol-13-acetát.
4.1. Účinky na bunkovú kultúru
Lipopolysacharid E. coli (LPS) stimuloval myšie mikrogliálne bunky BV-2 a inkuboval sa s PNLA v koncentrácii 50 μM, čo viedlo k zníženiu syntézy oxidu dusnatého (NO), IL-6 a TNF-α o 27–74% [17]. PNLA tiež významne znížila hladiny NO a PGE2 o 35 % v primárnych peritoneálnych makrofágoch potkanov po stimulácii LPS [29]. V ďalšej štúdii na bunkách HepG2 PNLA (25 μM) znížila produkovaný NO o 50 % [25]. Chen a kol. hodnotili účinky PNLA na LPS stimulované makrofágy THP-1 a zistili, že hladiny IL-6, TNF-α a PGE2 sa znížili o 46 %, 18 % a 87 % [19]. Predtým sa ukázalo, že PNLA znižuje syntézu PGE2 v myších makrofágoch RAW264.7 stimulovaných LPS [16]. V oboch štúdiách boli účinky PNLA závislé od dávky. PNLA tiež znížila tvorbu PGE1 alebo PGE2 v makrofágoch RAW264,7 stimulovaných DGLA alebo AA o 53 % a 22 % [16].
Keď sú makrofágy RAW264.7 stimulované LPS, iNOS a COX-2 mRNA a expresia proteínov sa zvyšujú, čo potom zvyšuje produkciu NO a PGE2. Dráha NF-κB sa normálne aktivuje počas up-regulácie génov iNOS a COX-2. Chen et al. (2015) preukázali, že PNLA znížila expresiu iNOS a COX-2 spôsobenú LPS o 55 % a 10 % [17]. To ukazuje, že ako bolo preukázané pre n-3 PUFA, PNLA môže blokovať aktiváciu NF-κB [1,28]. Huang a kol. uviedli podobné výsledky pri použití liečby 50 μM PNLA, ktorá znížila uvoľňovanie COX-2 a PGE2 z LPS stimulovaných RAW264.7 a primárnych peritoneálnych makrofágov potkanov [29]. [16] však zistili zvýšenie expresie proteínu COX-2 (12%) v myších makrofágoch, a to aj napriek zníženej produkcii PGE2. Naznačili, že pokles produkcie PGE2 môže byť spôsobený konkurenciou PNLA alebo jej metabolitov s AA ako substrátom pre COX-2 [16]. V súlade so zisteniami v bunkách RAW264.7 stimulovaných LPS, PNLA zabránila aktivácii NF-κB [29] a Baker a kol. preukázali, že PNLA (50 μM) znížila TNF-α stimulovala aktivitu NF-κB v bunkách EA.hy296 [20]. Okrem toho ICAM-1, MCP-1, regulované aktiváciou, normálnou produkciou exprimovaných a vylučovaných T buniek (RANTES) bunkami EA.hy296 stimulovanými TNF boli všetky znížené liečbou PNLA, ako aj adhéziou k ľudským monocytom THP-1 [20,27].
Jedna štúdia uviedla, že 50 a 100 μM PNLA znížila tvorbu PGE2 ľudskými bunkami rakoviny prsníka MDA-MB-231 stimulovanými 12-O-tetradekanoylforbol-13-acetátom (TPA) s nižšími hladinami COX-2 mRNA a proteínov [22]. Ďalšie testy v týchto bunkách ukázali, že n-3 (DHA) alebo PNLA znížili inváziu buniek o 30 % a 25 % a PNLA aj DHA inhibovali pohyblivosť buniek [22]. Experimenty preukázali, že PNLA bola najúčinnejšia z FA (PNLA, DHA alebo EPA) pri znižovaní produkcie PGE2. Zníženie PNLA produkcie PGE2 indukovanej TPA bolo závislé od dávky [22]. Zdá sa, že zníženie PGE2 PNLA, DHA alebo EPA bolo čiastočne sprostredkované zníženou expresiou COX-2 [22].
4.2. Účinky na zvieracie modely
Niekoľko výskumov na zvieratách tiež zdôraznilo protizápalové vlastnosti PNLA. PNLA znížila uvoľňovanie IL-1β, IL-6, TNF-α a PGE2 v chrbtovej koži stimulovanej TPA myšieho modelu, kde sa PNLA alebo vozidlo aplikovalo lokálne na oholenú pokožku chrbta. To súviselo so znížením fosforylácie p38- a c-Jun N-terminálnej kinázy (JNK)-mitogénom aktivovanej proteínkinázy (MAPK), ale nie extracelulárneho signálom regulovanej kinázy-MAPK [19]. Hodnotili sa aj supernatanty z homogenátov dorzálneho kožného tkaniva [19]. Infiltrácia leukocytov, neutrofilov a makrofágov bola hlásená znížená po jednej injekcii PNLA (3 g) u myší s opuchom ucha vyvolaným TPA [19]. Autori naznačili, že tieto účinky môžu vyplývať skôr z priamej regulácie bunkovej signalizácie ako z absorpcie PNLA do buniek.
U potkanov PNLA podávaná perorálne pred injekciou karagénanu do pravej nohy znížila edém [24]. PNLA aplikovaná lokálne na chodidlá tiež znížila horúčku. Navyše, po vstreknutí PNO do pravej zadnej labky sa reakčný čas na horúcu platňu zvýšil 1,4-násobne [24]. To ukazuje, že aktivita COX-2 a uvoľňovanie PGE2 môžu hrať úlohu v analgetických účinkoch PNLA.
The effects of dietary PNO on immune function were examined in other animal studies. Rats were given P. koraiensis oil by Matsuo et al. and then intraperitoneal ovalbumin as an immunization [30]. Rats given safflower oil (a source of LA; n-6) or evening primrose oil (EPO; a source of GLA; n-6) had reduced CD4 T-cell counts, as well as spleen cells’ synthesis of Leukotriene B4 (LTB4) and immunoglobulins (Ig)-E and-G, compared to those given PNO [30] suggesting that PNLA may modulate the immune response. Park et al. found that PNO feeding led to an increase in concanavalin A-stimulated splenic lymphocyte proliferation and IL-1β production by splenocytes activated with LPS [31]. Lin et al. (2017) also reported that a low dose of P. koraiensis could enhance the immune function in vivo, with elevated quantities of IL-2, IL-4, IL-10, and interferon (IFN)-γ in mice [32]. These observations contradicted the reported anti-inflammatory effects of PNLA [16,17]. However, these immune-enhancing effects may be due to non-PNLA components in PNO or inherent differences in the models.
4.3. Effects on Healthy Individuals and Patients with Chronic Inflammatory Diseases
More recently, Takala et al. confirmed some of the anti-inflammatory actions of PNLA in healthy volunteers and RA patients [5]. In PBMCs from RA patients stimulated with LPS, PNLA decreased IL-6 and TNF-α release by 60%, whereas in HCs, it did so by 50% and 35%, respectively. LPS-induced PGE2 levels in such PBMCs from RA patients and HCs were also reduced substantially by PNLA. Regarding IL-1β, levels were reduced in supernatants of activated PBMCs of HCs while unaffected in RA patients after treatment with PNLA.
Keď sa hodnotili intracelulárne hladiny IL-6, TNF-α, IL-1β a IL-8 v monocytoch CD14 izolovaných od aktívnych pacientov s RA, došlo k zníženiu TNF-α, IL-6 a IL-1β, všetky približne o 25 % a zníženiu hladiny IL-8 o 20 % bez vplyvu na expresiu MCP-1 [6]. PNLA tiež významne znížila podiel monocytov CD14 aktivovaných LPS u pacientov s RA zo 66,8 % na 58,4 % a 56,3 % pre 25 a 50 μM PNLA [6]. Nebola zistená žiadna korelácia medzi znížením počtu rôznych cytokínov exprimujúcich monocyty CD14 pomocou PNLA a klinickými a laboratórnymi znakmi RA alebo skóre aktivity ochorenia.
Takala a kol. tiež použili transkriptomiku celého genómu a skúmali zápalové modely PBMC od pacientov s RA a zdravých dobrovoľníkov, ako aj purifikované monocyty CD14 od aktívnych pacientov s RA, ktoré boli aktivované 100 ng/ml LPS po predinkubácii s 25 μM PNLA. Bioinformatická analýza ukázala, že NF-κB, STAT a chemokínový receptor 2 (CCR2) boli inhibované v porovnaní s rovnakým modelom, ktorý bol ošetrený vehikulom a stimulovaný LPS, zatiaľ čo bola pozorovaná zvýšená expresia PPAR [5,6]. PNLA tiež regulovala expresiu metabolických génov, vrátane pyruvátdehydrogenázy-kinázy-4 (PDK4) a člena rodiny serpínov E 1 (SERPINE1), ktorý kóduje inhibítor aktivátora plazminogénu-1 (PAI-1) z HC a fruktóza-bisfosfatázu 1 (FBP1), PDK4 a N-Myc následný regulátor 2 (NDRG2) od pacientov s RA [5], ako je uvedené v tabuľke 2 a tabuľke 3, resp. Okrem toho v roku 2022 uviedli, že existuje veľa génov kódujúcich proteíny, ktorých expresia bola ovplyvnená liečbou 25 μM PNLA purifikovaných monocytov CD14 od pacientov s RA stimulovanou 0,1 μg/ml LPS, ako je uvedené v tabuľke 4. Tieto štúdie tiež preukázali, že PNLA sa podieľa na inhibícii aktivity NF-κB a tým aj na následných účinkoch na zápalové mediátory. V tomto ohľade má PNLA podobné účinky ako n-3 PUFA (EPA a DHA), ktoré boli preskúmané v [1,26].
Tabuľka 2.
Prvých desať génov, ktorých expresia v LPS stimulovaných PBMC z HC bola ovplyvnená predbežnou liečbou PNLA v porovnaní s vehikulom.
| Názov génu | Biotyp génu | Zmena výrazu |
|---|---|---|
| PDK4 | Kódovanie proteínov | zvýšiť |
| TMEM52B | Kódovanie proteínov | zvýšiť |
| AC092118.1 | lncRNA | zvýšiť |
| CPT1A | Kódovanie proteínov | zvýšiť |
| SERPINE1 | Kódovanie proteínov | zvýšiť |
| AC087289.4 | lncRNA | zvýšiť |
| IGSF6 | Kódovanie proteínov | zvýšiť |
| AKR1C1 | Kódovanie proteínov | zvýšiť |
| AC138207,5 | lncRNA | zvýšiť |
| TSPAN10 | Kódovanie proteínov | zvýšiť |
Tabuľka 3.
Desať najlepších génov, ktorých expresia v LPS stimulovaných PBMC od pacientov s RA bola ovplyvnená predbežnou liečbou PNLA v porovnaní s vehikulom.
| Gene Name | Gene Biotype | Change in Expression |
|---|---|---|
| FBP1 | protein coding | increase |
| PCAT7 | lncRNA | increase |
| NDRG2 | protein coding | increase |
| PDK4 | protein coding | increase |
| AC015660.2 | lncRNA | increase |
| LINC02244 | lncRNA | increase |
| LRRC32 | protein coding | increase |
| LOXL2 | protein coding | increase |
| CD163L1 | protein coding | decrease |
| DIXDC1 | protein coding | increase |
Table 4.
Upregulated and downregulated protein-coding genes in CD14 monocytes from patients with RA following PNLA treatment and LPS stimulation versus vehicle treatment and LPS stimulation.
| Upregulated Genes | Downregulated Genes |
|---|---|
| LY6G5B | SPCS1 |
| PDK4 * | RHNO1 |
| BRF1 | MRPL9 |
| ACAA2 | MT-ND1 |
| ZBTB34 | HSPA1L |
| ACADVL * | MT-CO2 |
| AC007375.2 | CHCHD4 |
| SPINK4 | NIT1 |
| AC090227.2 | OTUB1 |
| CPT1A * | PAIP1 |
| GRIK1 | MEN1 |
| HSD17B8 | OTUB1 |
| NPEPL1 | MEN1 |
| ZNF48 | MT-ATP6 |
| ANKRD23 | ENOX2 |
| CCER2 | LSM1 |
| SLC25A42 | ARL2BP |
| GHRL | MT-ND5 |
| ALG13 | MT-ND4 |
| CRABP2 | SLC10A3 |
| MTRNR2L8 | DEDD |
| ROM1 | DSTN |
| ST14 | DCTN2 |
| SIGIRR | TRAPPC2L |
| ETFA | EDARADD |
| JMJD7-PLA2G4B | NDUFA7 |
| SLC25A20 * | GZF1 |
* Indicate genes that are consistently regulated by both CD14 monocytes and PBMCs of RA patients in separate studies.
5. PNO and PNLA Inhibit Oxidative Reactions
Dietary antioxidants may improve chronic diseases by reducing oxidative damage [33]. Antioxidant enzymes are essential for cell defense against the harm that free radicals may do to cells and macromolecules. Two of these enzymes are phospholipid hydroperoxide glutathione peroxidase (GSH-Px) and superoxide dismutase (SOD). P. koraiensis oil was included in a meal given to rats, and they showed elevated blood levels of SOD and GSH-Px activity [34]. Malondialdehyde (MDA) is a sign of lipid degradation caused by free radicals and is commonly used as a biomarker for measuring lipid peroxidation in cell membranes. There was a reduction in serum MDA levels in the PNO-fed group relative to the control [34]. Additionally, in comparison to the controls, the pine high-fat diet (PHFD) group had the greatest level of SOD2 mRNA compared to PNO and soybean oil (SBO)-fed groups and soybean high-fat diet (SHFD) groups [34], which might shield from damage due to ROS. In H2O2-induced HepG2 cells, 1, 5, and 10 μM of PNLA, dose-dependently reduced intracellular ROS accumulation by 29.1, 59.1, and 65.5% and intracellular MDA content by 15.96%, 20.5%, and 22.9%, respectively [35]. These data suggest that PNLA reduces ROS-induced lipid peroxidation, thereby decreasing oxidative damage [3]. Although Takala et al. found that PNLA (25–100 μM) has no effect on ROS in THP-1 monocytes and macrophages in vitro [5], they found that 25 μM PNLA reduced NO production by PBMCs (unpublished observation). NO is considered one of the oxidative stress mediators.
Nuclear factor erythroid 2-related factor 2 (NRF2) was translocated to the nucleus by PNLA in order to protect cells from oxidative stress, and the expression of the antioxidant enzymes heme oxygenase-1 (HO-1) and quinone dehydrogenase-1 that are downstream of NRF2 was also increased [35]. The NRF2 transcription factor is a key regulator in cellular antioxidant defense responses [36]. The Kelch-like ECH-associated protein 1 (KEAP1) expression was decreased; according to Zhao et al., these changes also activate the production of antioxidant enzymes leading to a decrease in MDA production, which protects against damage by ROS [35].
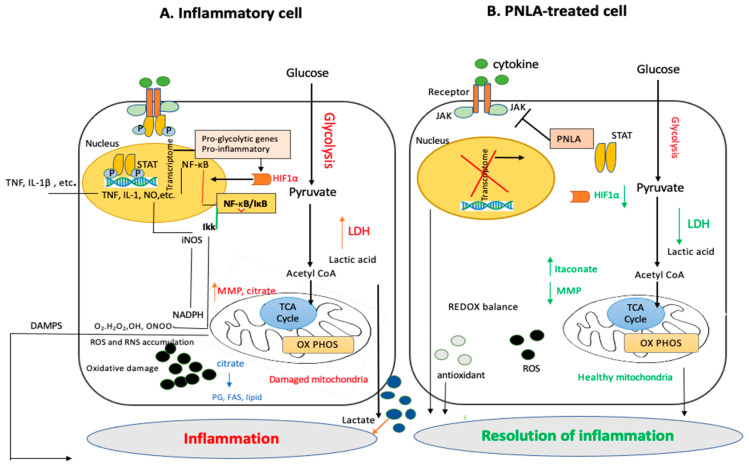
Oxidative damage and repair are perpetual processes in vivo. Inflammation is exacerbated by oxidative damage, which is increased when damaged biomolecules are not replaced [37,38]. Under inflammatory conditions, as shown in Figure 3, hypoxia inducible factor-1 (HIF-1), a member of the basic ARNT-protein family and typically a heterodimer consisting of HIF-1α and HIF-1β subunits, provides a means of regulating gene expression that operates at a molecular level in response to the availability of oxygen. This idea inspired the production of medications that have been licensed for inhibiting HIF-1 [39]. HIF-1 activates pro-inflammatory genes such as NF-κB and STATs. STATs, once phosphorylated by activated Janus Kinases (JAKs), enables the production of cytokines that are pro-inflammatory. A transcription factor called Aryl hydrocarbon receptor nuclear translocator 2 (ARNT2) controls the transcription of HIF-1. ARNT2 expression was found to be inhibited by 25 μM PNLA in PBMCs from RA patients (unpublished data). Takala et al. also found that oxidative phosphorylation (OXPHOS) is the most significant canonical pathway to be inhibited in purified CD14 monocytes isolated from active RA patients followed by mitochondrial dysfunction [6]. PNLA potentially reduces lactate dehydrogenase (LDH) via activation of PDK4, which leads to less lactate and acetyl CoA that consequently results in the inhibition of OXPHOS [6]. By inhibiting OXPHOS, PNLA may reduce the ability of pathogenic cells to generate sufficient ATP to survive, proliferate, and function, thus promoting the resolution of inflammation through metabolic reprogramming. Some of the putative molecular activities of PNLA based on the control of OXPHOS are summarized in Figure 3. It may be possible to gain insight into the interaction between inflammation, immunological metabolism, and some antioxidant protective activities of PNLA by learning more about the factors that affect the way that PNLA functions in chronic inflammatory disorders.
Figure 3.
6. PNLA and PNO protect against Hyperlipidaemia and Atherosclerosis and Regulate the Lipid and Metabolic State Based on Cell Line, Animal, and Human Studies
The imbalance between exercise and dietary intake is considered the main cause of an increase in body fat [40,41]. An increase in body fat, especially visceral fat, is associated with diseases, including osteoarthritis, cardiovascular disease (CVD), hyperlipidaemia, hypertension, and type 2 diabetes (2DM) [42,43]. Weight reduction and reducing visceral fat accumulation is therefore important for health.
Pine nuts are cholesterol-free and a good source of nutrients. According to the outcomes of studies on animals, PSO considerably reduced blood pressure and had cholesterol-lowering effects [44,45]. PNO diminished lipid accumulation in the rat liver and produced a decrease in lipid profile, lipoprotein cholesterol, and liver weight, which was concentration-dependent [7]. It had no hepatotoxic or detrimental effect on the liver as hepatic enzymes, such as serum alanine transferase (ALT), aspartate transferase (AST) and alkaline phosphatase (ALP) levels, were unaffected by PNLA in rabbits [8]. Jin et al. also reported that even though there was a trend of increasing AST, ALT, protein urea nitrogen, and creatinine in animals fed with high fat diet (HFD), the levels remained normal showing that PNO was neither hepatotoxic nor nephrotoxic in mice [46].
Dietary maritime pine seed oil (MPSO) has been demonstrated to reduce TG, VLDL-triglycerides, and VLDL-cholesterol in rats in vivo, and diminished cholesterol efflux in vitro in cultured cells of mice expressing human apolipoprotein (Apo) A-I, according to a study by Asset et al. [45]. Moreover, a diet containing MPSO reduced HDL and ApoA-I levels when human ApoA-I and ApoB genes are expressed in transgenic mice. There are several hypotheses that have been suggested for hypolipidemic properties, one of them is that PNLA alters the expression of various Apo genes that have an essential role in lipid metabolism. Key proteins of HDL are ApoA-I and ApoA-II, lipoprotein remnant clearance requires ApoE, and the main component of TG-rich bioparticles is ApoC-III, which reduces VLDL lipolysis and uptake [47]. Other mechanisms that have been suggested for TAG-reducing properties of PNLA are diminished substrate availability to produce lipoproteins, lowered de novo lipid synthesis, or alterations in very low-density lipoprotein (VLDL) physicochemical properties [45,47]. Furthermore, PNLA reduced the activity of the lipid anabolic pathway in vitro in hepatoma HepG2 cells by downregulating the expression of genes associated with lipid synthesis and lipoprotein uptake. For example, long-chain acyl-CoA synthetases (ACSLs) mediates the formation of fatty acyl-CoA from FAs (lipid biosynthesis). In comparison to the BSA control group, PNLA decreased the mRNA levels of ACSL3, and ACSL4 by 30 and 20%, respectively [8].
Many inflammatory processes are generally initiated by monocyte migration; in the case of atherosclerosis, monocytes migrate from the lumen into the intima, and in RA they migrate into inflamed synovium. Monocytes once migrated undergo pathologic transformation into macrophages and commence the inflammatory process within the artery or the synovial joint. Recently, Takala et al. demonstrated that PNLA reduced migration of THP-1 monocytes induced by MCP-1 by more than a half in vitro. Macropinocytosis and DiI-oxLDL uptake were also decreased by 50% and 40% in differentiated THP-1 macrophages and by 40% and 25% in HMDM, respectively [5]. Both processes lead to lipid accumulation and the formation of atherogenic plaque.
PNO-FA induced higher internalization of Dil-LDL in HepG2 cells [48] suggesting that PNO-FA may lower LDL by increasing uptake by the liver. When compared to other oils, rats fed PNO had lower serum TAG and VLDL-TAG concentrations, according to Asset et al; however, despite the effects being relatively high, the differences were not statistically significant [45]. Lower serum total TAG levels in rats fed P. koraiensis oil compared to rats fed lard were similar but significant in findings reported by Park et al. [11].
According to Park et al. (2016), the PHFD group’s response on fatty acid synthase (FAS) mRNA expression was considerably less than that of the SHFD group. Lipogenesis was decreased in the PHFD group but not in the SHFD group [49]. After 16 weeks of feeding, Ferramosca et al. (2008) found that PNO-fed mice had considerably lower activity levels of hepatic lipogenic enzymes such as acetyl-CoA carboxylase and FAS and that PNO-fed mice were protected from liver fat accumulation when fed conjugated linoleic acid (CLA) [50,51]. Compared to SHFD, the body weight gain and mass of white adipose tissue were lower in PHFD (10% and 18% lower, respectively). In comparison to the SHFD, the PHFD had much lower liver TG levels (26% lower). Intake of PNO increased hepatic acyl-CoA dehydrogenase long chain (ACADL) mRNA levels [51]. These data indicate that PNO increases hepatic FA-β-oxidation and reduces lipogenesis.
Predpokladalo sa, že PNLA aktivuje PPAR u pacientov s RA a u zdravých dobrovoľníkov [5,6]. PPAR-γ zvýšil výtok cholesterolu z makrofágov pečeňovou dráhou receptora X pečene [52,53]. Okrem toho PPAR-γ reguluje diferenciáciu adipocytov a homeostázu glukózy, ako aj črevnú homeostázu prostredníctvom modulácie prozápalových reakcií sprostredkovaných NF-κB [52,53,54]. Nízky PPAR-γ znižuje ukladanie tuku v tukovom tkanive, čo vedie k ukladaniu tuku v tukových tkanivách. PPAR-γ tiež reguluje hladinu leptínu v plazme, citlivosť na inzulín, homeostázu glukózy a krvný tlak, ako aj účinky antidiabetík. Okrem toho zabraňuje uvoľňovaniu zápalových cytokínov a aktivácii makrofágov [52]. Ateroskleróza na zvieracích modeloch a štúdiách na ľuďoch je inhibovaná agonistami PPAR [52,55,56], takže sú potenciálnou liečbou KVO a 2DM [57,58]. To všetko naznačuje, že existuje metabolický prospešný účinok PNLA, ktorý môže byť sprostredkovaný aktiváciou PPAR-γ, aj keď existuje kontroverzia týkajúca sa PNO efektu, ktorý môže znížiť PPAR-γ, ako uvádza [46].
V porovnaní so svetlicovým olejom (SAO) olej z Pinus koraiensis znížil hladinu cholesterolu v krvi a znížil zvýšenie krvného tlaku u potkanov spojené s vekom, hoci ľanový olej (FSO) bol v tejto štúdii účinnejší ako PNO [44]. PNO stimulovalo produkciu CHZO aorty viac ako SAO a rozdiel medzi skupinami PNO a SAO bol významný. Liečba PNO tiež zabránila zvýšeniu krvného tlaku súvisiacemu so starnutím po 5 týždňoch a pretrvávala počas 8 týždňov [44]. Autori dospeli k záveru, že extrakty z píniových orieškov nielen znižujú krvný tlak, ale znižujú aj poškodenie obličiek spôsobené hypertenziou. Výťažky z borovicovej kôry a píniové oriešky tiež preukázali sľubné kardiovaskulárne (CV) výhody, vrátane zlepšenia funkcie endotelu, zníženia plazmatického fibrinogénu a zníženia viskozity plazmy a systolického krvného tlaku [3,27,59,60]. Tieto výsledky boli pripísané rôznym typom FA v píniových orieškoch, najmä PNLA alebo niektorým jej metabolitom. V štúdii Amra a Abeera sa u potkanov kŕmených stravou s vysokým obsahom tukov vyvinula zahustená tunica media spojená s množením hladkého svalstva v aorte, okrem vakulácie tunica media v aorte. V druhej skupine potkanov mala cholesterolová strava doplnená o 5 a 10% píniových orieškov vakuoly tunica media. V tretej skupine však potkany kŕmené stravou doplnenou 15% píniových orieškov vykazovali normálnu histologickú štruktúru [7].
V porovnaní s kukuričným olejom v akútnom myšom glukózovom tolerančnom teste PNO a čistá PNLA (voľná a esterifikovaná) podstatne zlepšili glukózovú toleranciu [61]. Výsledky in vitro naznačili, že PNLA je silný agonista duálneho voľného FA receptora-1 a voľného FA receptora-4 (FFA1/FFA4) [61,62], ktorý má antidiabetické účinky. Rôzne typy neesterifikovaných FA so stredným až dlhým reťazcom (NEFA) boli spojené rôznymi spôsobmi pri 2DM a iných metabolických a zápalových ochoreniach a FFA1 a FFA4 sú transmembránové receptory spojené s G proteínom, ktoré sú aktivované týmito NEFA. FFA1 je exprimovaný v β bunkách pankreasu, zatiaľ čo FFA4 je exprimovaný v črevných enteroendokrinných bunkách, makrofágoch, pankrease, tukovom tkanive a mozgu. Zdá sa, že koaktivácia FFA1 zvyšuje produkciu inzulínu, ktorý je závislý od glukózy [63,64] a FFA4 podporuje citlivosť na inzulín a má protizápalové účinky [65,66]. Etylénom prerušená PNLA patrila medzi najúčinnejšie NEFA na FFA1 a FFA4 v porovnaní s ALA, AA, DGLA a GLA. PNLA prekonala všetky tieto FA v podpore zdravia a zlepšení citlivosti na inzulín [61].
In various studies where mice are given HFDs containing PNO, there was weight reduction and less weight gain [31,49]. White adipose tissue mass was decreased because of these alterations [31,49,67], most likely as a result of increased oxidative metabolism and thermogenesis, which drives the utilization of fuel sources and reduces lipid accumulations. Therefore, the effect of PNO and PNLA on weight could be the result of both increased energy expenditure and decreased intake. Earlier in 2008, Hughes et al. reported a rise in the satiety hormones glucagon-like peptides (GLP-1) and cholecystokinin (CCK-8), in postmenopausal obese women participating in a pilot double-blind placebo-controlled clinical trial [2,68] when taking 3 g Korean pine nuts (KPN)-FFA in comparison with 3 g KPN-TG or 3 g olive oil. The levels of circulating CCK-8 in the PNO FFA and PNO TAG groups, respectively, were 60% and 22% higher. Comparing the PNO FFA group to the control, GLP-1 rose by 25% [2, 69]. Food intake also diminished by 36% in the PNO FFA group [2,68,69] suggesting that pine nuts may also be an appetite suppressant.
7. Novel Potential Metabolic, Anti-Inflammatory, and Immune-Regulatory Effects Discovered by Transcriptomic and Bioinformatic Analyses
In C57BL/6 mice, Zhu et al. discovered decreased hepatic mRNA expression of ACADL, adipose triglyceride lipase (ATGL), carnitine palmitoyltransferase (CPT) 1A, and Apo-B100 as well as decreased gut mRNA expression of both CD36 and Apo-A4 [67]. This implies that dietary PNO may reduce the uptake of intestinal FA and increase hepatic mitochondrial FA oxidation.
PNLA downregulated the expression of genes related to FA biosynthesis (fatty acid synthase (FAS), sterol regulatory element-binding protein 1(SREBP1), and stearoyl-CoA desaturase 1 (SCD1)) in the human hepatoma cell line (HepG2) when compared to control (53, 54, and 38% lower, respectively). Furthermore, the mRNA levels of genes related to cholesterol synthesis and lipoprotein uptake (3-hydroxy-3-methyl-glutaryl-coenzyme A reductase (HMGCR), and LDL receptor (LDLr), respectively) were significantly suppressed (30, and 43%, respectively) by PNLA [8,27]. The cholesterol-reducing capability of PNLA has been associated with a greater hepatic accumulation of PNLA and regulation of hepatic activity through boosted hepatic LDLr gene expression and elevated levels of SREBP2 [70].
Studies of protein–protein interaction networks (PPINs) by bioinformatic analyses are crucial for delineating how intracellular proteins work. Investigating a protein’s interaction with other proteins whose activities are known can help reveal those proteins whose functions are not fully identified [46]. Therefore, PPIN analysis was conducted to shed light on the molecular mechanisms underlying PNLA’s metabolic and immunological effects as demonstrated by Takala et al. [5,6] and Jin et al [46]. Takala et al. identified that 25 μM PNLA treatment of LPS-activated CD14 monocytes activated Kruppel-like factor 15 (KLF15), argonoute-2 (AGO2), ficolin (FLCN), Sirtuin3 (SIRT3) and Sirtuin signalling pathways and reduced the activity of STAT3, Transcription factor E3 (TFE3), and Death associated protein-3 (DAP3) pathways [5,6].
KLF15 je transkripčný faktor, ktorý riadi zápal a iné patogénne procesy spojené s aterosklerózou, ako aj kontrolu rôznych signálnych dráh [71]. Moduluje stav acetylácie a aktivitu NF-κB a riadi aktiváciu buniek hladkého svalstva ciev (VSMC) [72]. Niekoľko kardiovaskulárnych ochorení, vrátane srdcového zlyhania, progresívnej zápalovej vaskulopatie a aneuryzmy aorty, bolo spojených so zníženou expresiou KLF15 [71]. Expresia mRNA KLF15 je znížená v aterosklerotickom tkanive ľudskej aorty v porovnaní s neaterosklerotickými kontrolnými aortami [71]. Nadmerná expresia KLF15 v ľudských bunkách EA.hy926 vykazovala ochranný účinok proti dysfunkcii vyvolanej TNF-α a znížila hladiny fosfo-p65 (p-p65), ICAM-1, MCP-1 a TGF-β [71]. AGO2 hrá úlohu pri interferencii RNA a umlčanie miRNA je ovplyvnené proteínmi Ago [73,74,75]. Pôsobenie PNLA môže byť čiastočne sprostredkované jej účinkom na AGO2, a tým aj na prozápalové miRNA. V aktivovaných makrofágoch TFEB a TFE3 riadia autofágiu a lyzozomálnu aktivitu a sú rozhodujúce pre transkripciu prozápalových cytokínov, ako sú TNF-α a IL-1β [76]. DAP3 je malý podjednotkový proteín nachádzajúci sa v mitochondriálnom ribozóme, ktorý sa podieľa na mitochondriálnej funkcii a rôznych formách bunkovej smrti [77]. Nadmerná expresia DAP3 vedie k zvýšeniu bunkovej smrti a osteoklastogenézy [77]. DAP3 pôsobí po pro-apoptotických cytokínových stimuloch, ako je IFN-γ a pred niekoľkými kaspázami, najmä kaspázami 8 a 9 [77]. Niektoré z účinkov PNLA môžu byť sprostredkované jeho inhibičným účinkom na DAP3, ako je apoptóza a inhibičný účinok týchto prozápalových cytokínov. V PBMC od zdravých dobrovoľníkov PNLA dramaticky zvýšila expresiu PAI-1, ktorý produkuje proteín, ktorý inhibuje enzýmy zodpovedné za tvorbu plazmínu z plazminogénu, tkanivového aktivátora plazminogénu (tPA) a aktivátora uro-plazminogénu (uPA). V synovii RA je expresia uPA vysoká vo vrstvách synoviálnej výstelky [78]. U TNF-transgénnych myší nedostatok plazminogénu znižuje synoviálny zápal a degeneráciu kĺbov prostredníctvom zníženia cytokínov a matricových metaloproteináz (MMP) [79].
FBP1 je súčasťou glykolytickej dráhy, ktorou sa fosforyluje fruktóza-6-fosfát. Expresia génu pre FBP bola tiež zvýšená PNLA v PBMC od pacientov s RA. Má protizápalové vlastnosti a podávanie FBP znižuje artritídu so zníženým opuchom kĺbov a prozápalovými hladinami cytokínov [80].
Expresia ACADL a PPAR-α, γ a δ mRNA bola zvýšená v ľudských PBMC a monocytoch CD14 [5,6]. PNLA potenciálne vyvolala aktivitu ligandu pre PPAR-α a PPAR-δ, pretože liečba týmto FA zvýšila cieľové gény PPAR-α a PPAR-δ zapojených do oxidácie FA, vrátane receptora-gama koaktivátora aktivovaného peroxizómovým proliferátorom (PGC)-1α, mitochondriálneho oddeľovacieho proteínu 3 (UCP3), karnitín palmitoyltransferázy 1B (CPT1b), stredného reťazca acyl-CoA dehydrogenázy (ACADM) a ACADL v bunkovej línii myotrubíc C2C12 [34] a PBMC od pacientov s HC a RA [5]. Park a kol. navrhli, že ligandová aktivita PNLA pre PPAR-α a PPAR-δ môže byť hlavným mechanizmom zníženej adipozity u myší kŕmených PNO [31,49]. Túto aktiváciu naznačili aj iní ako jeden z dôvodov protizápalových vlastností PNLA, ako je inhibícia AP-1, NF-κB a STAT [5,27,81]. Na určenie, či PNO ovplyvnilo hladiny expresie PPAR-γ a SREBP-1c v tukovom tkanive nadsemenníka, Jin a kol. použili RT-PCR. Zatiaľ čo orlistat, liek na chudnutie, a skupiny PNO vykazovali významnú reguláciu expresie PPAR-γ v tukovom tkanive nadsemenníka v porovnaní so skupinou HFD, expresia PPAR-γ bola zvýšená v skupine HFD v porovnaní so skupinou s normálnou stravou (ND) [46]. PNO (822 a 1644 mg/kg) znížil upreguláciu mRNA leptínu v nadsemenníku v porovnaní so skupinou HFD spôsobom závislým od dávky. Okrem toho PNO tiež znížil expresiu mRNA lipoproteínovej lipázy (LPL).
Pri chronickom obmedzení kalórií (CR) je známe, že SIRT, deacetyláza závislá od NAD + triedy 3, je zvýšená. SIRT znižujú expresiu génov, ktoré podporujú aterosklerózu [6,82,83]. SIRT3 je v podmienkach CR zvýšená regulácia a hrá zásadnú úlohu pri riadení mitochondriálnej funkcie. SIRT3 je primárna mitochondriálna forma, ktorá podporuje oxidáciu FA, posilňuje antioxidačný obranný systém a opravuje poškodenie mitochondriálnej DNA [82]. Pri obezite vyvolanej HFD konzumácia PNO znížila telesný tuk a akumuláciu TG v pečeni [49]. SIRT3 je nový cieľ ochrany pred lipotoxicitou a metabolickými problémami súvisiacimi s obezitou [82]. Expresia génu SIRT3 bola zvýšená o 25 μM PNLA v purifikovaných monocytoch od pacientov s RA [6]. Expresia proteínu SIRT3 bola zvýšená v bielom tukovom tkanive myší kŕmených PNO [34]. Najmä NF-κB RelA/p65, transkripčný faktor rodiny AP-1 c-Jun a c-Myc sú častými substrátmi SIRT1. SIRT1 deacetyloval RelA/p65 a znížil aktivitu NF-κB [84,85,86]. SIRT1 významne znížil produkciu IL-12 v ľudských dendritických bunkách (DC) prostredníctvom svojho vplyvu na transkripčný faktor NF-κB c-Rel [84,85]. Okrem toho ďalšie štúdie ukázali, že SIRT1 v chondrocytoch a synoviálnych bunkách reguluje rôzne typy buniek počas zápalovej artritídy [84,85,87]. Správy tiež potvrdili, že hladiny TNFα indukované LPS v monocytoch boli znížené nadmernou expresiou neaktívnej formy SIRT1 [87].
8. PNLA and Modulation of miRNAs
Takala et al., for the first time, showed a novel correlation between the relative expression levels of the miRNA’s targets and PNLA treatment. The miRNAs that were up or downregulated from 8 RA patients’ pure monocytes with active disease are summarized in Table 5. Monocytes upon PNLA treatment and LPS stimulation versus vehicle treatment and LPS stimulation resulted in differential expression of 68 miRNAs, 8 down-regulated and 60 up-regulated [6].
Table 5.
Key down-regulated and up-regulated miRNAs in PNLA treated, LPS-stimulated versus vehicle treated LPS-stimulated CD14 monocytes from patients with RA. “Adapted with permission from Takala et al. [6]. Copyright 2022, Scientific Reports”.
| Downregulated miRNA | Upregulated miRNA |
|---|---|
| mIR637 | mIR8066 |
| mIR4326 | mIR1276 |
| mIR6886 | mIR3173 |
| mIR1909 | mIR664B |
| mIR671 | mIR6773 |
| mIR7111 | mIR6778 |
| mIR374C | |
| mIR374B | |
| mIR3161 | |
| mIR219B | |
| mIR3922 | |
| mIR219A2 | |
| mIR1914 | |
| mIR505 | |
| mIR3140 | |
| mIR941-3 | |
| mIR324 | |
| mIR4722 | |
| mIR4755 | |
| mIR3176 | |
| mIR3978 | |
| mIR4435-2 | |
| mIR4440 | |
| mIR1470 | |
| mIR570 | |
| mIR6719 |
Table 6 displays the pathways connected to inflammation and lipid/cell metabolism that PNLA may control. The targets of these miRNAs were discovered through bioinformatic analyses to be several metabolic and anti-inflammatory mRNAs, including pyruvate dehydrogenase kinase-4 (PDK4), single-immunoglobulin interleukin-1 receptor-related molecule (SIGIRR), mitochondrial-ATP-6 (MT-ATP6), ghrelin and obestatin prepro-peptide (GHRL), jumonji domain containing 7-phospholipase A2 (JMJD7-PLA2G4B), and electron transfer flavoprotein subunit alpha (EFTA). These genes play a role in the control of inflammation, mitochondrial dysfunction, and lipid and cell metabolism. Adipocyte function, glucose metabolism, insulin secretion signalling pathways, CCK secretion, mitochondrial ATP synthase, the NAD signalling pathway, and FA β-oxidation were among the metabolic signalling pathways identified.
Table 6.
Selected miRNAs target specific mRNAs and the signalling pathways that they are linked to, according to the Ingenuity pathway Analysis (IPA) database. “Adapted with permission from Takala et al. [6]. Copyright 2022, Scientific Reports”.
| miRNA ID | Change in Expression | mRNA Target | Effect | Pathway(s) |
|---|---|---|---|---|
| miR-3173 | increase | CRABP2 | Increase | Acute phase response, signalling for apoptosis mediated by retinoic acid, and regulation of cellular processes by glucocorticoids. |
| miR1260B | increase | JMJD7-PLA2G4B | Increase | VEGF family ligand-receptor interactions, ERK/MAPK signalling, glucocorticoid receptor signalling, MIF regulation of innate immunity, MIF-mediated glucocorticoid regulation, p38 MAPK signalling, and phospholipase C signalling. |
| miR-646 | increase | |||
| miR-1909 | decrease | FZD2 | Decrease | Pathways for adipogenesis, osteoarthritis, and the control of macrophages, fibroblasts, and endothelial cells in rheumatoid arthritis, as well as osteoblasts, osteoclasts, and chondrocytes. |
| miR-1909 | decrease | SIGIRR | Increase | Signalling from the NF-κB transcription factor, TLRs, and TREM1. Signalling by IL-6, TNF-α, and IL-1. Both anti-atherogenic and anti-inflammatory pathways. |
| miR-7150 | increase | |||
| miR-6868-5P | increase | |||
| miR-2861 | decrease | LSM1 | Decrease | Systemic lupus erythematosus signalling. |
| miR-374B | increase | ETFA | Increase | NAD signalling pathway involved in energy production from fats and proteins. |
| miR-4440 | increase | ATMIN | Decrease | Control of the cell cycle checkpoint by CHK proteins. Role in development of the immune system. |
| miR-4440 | increase | GHRL | Increase | Leptin signalling in obesity, appetite and growth hormone regulation. |
| miR-548L | increase | |||
| miR-626 | increase | PDK4 | Increase | Reelin signalling, glucocorticoid receptor signalling, and senescence pathways. TNF-α and NF-κB checkpoint. Lipid and glucose metabolism regulation. Associated with mitochondrial function and cellular energy regulation. Improves VSMCs oxidative stress resistance. |
| miR-3173 | increase | |||
| miR-2861 | decrease | |||
| miR-28 | increase | |||
| miR-7150 | increase | |||
| miR-3188 | increase | |||
| miR-637 | Decrease | SPCS1 | Decrease | Insulin secretion signalling pathways. |
| miR-671 | Decrease | MT-ATP6 | Decrease | Glucocorticoid receptor signalling, mitochondrial dysfunction, oxidative phosphorylation, sirtuin signalling pathway. |
| miR-Let-7 | increase | PDE12 RRP1B TARBP-2 GZF1 NRAS | All decrease | Anti-inflammatory and anti-atherogenic actions. Suppression of immune-modulatory cytokines IL-6 and IL-10. TLR4 signalling. |
CRABP2, Cellular Retinoic Acid Binding Protein; CHK, Checkpoint Kinase; ETFA, Electron Transfer Flavoprotein Subunit alpha; ERK/MAPK, Extracellular signal-regulated kinase/Mitogen activated protein kinase; FZD2, Frizzled Class Receptor 2; GHRL, Ghrelin Additionally, Obestatin Prepropeptide; JMJD7-PLA2G4B, Jumonji Domain Containing 7-Phospholipase A2; LSM1, Like Protein U6 Small Nuclear RNA Associated; MIF, Macrophage migration inhibitory Factor; MT-ATP6, mitochondrial encoded ATP synthase membrane subunit-6; NAD, Nicotinamide adenine dinucleotide; PDK4, pyruvate dehydrogenase kinase-4; PDE12, phosphodiesterase-12; SPCS1,Signal Peptidase Complex Subunit 1; TLR, Toll-like receptor; NF-κB; nuclear factor kappa-light-chain-enhancer of activated B cells; SIGIRR, single-immunoglobulin interleukin-1 receptor-related molecule; TREM1, Triggering receptor expressed on myeloid cells 1; VSMC, Vascular smooth muscle cells; VEGF, vascular endothelial growth factor.
Ten miRNAs target PDK4, which controls TNF-α and NF-κB [5,88]; miR-3173, miR-2861, miR-626, miR-28, miR-7150, miR-3188, miR-879-5p, miR-393-5p, miR-708-5p, and miR-12118 [6]. Cellular metabolism depends on PDK4, and PDK4 deficiencies result in the death of hepatocytes by apoptosis with an increase in mitochondrial numbers, ROS production, prolonged activation of c-Jun N-terminal kinase (JNK), and decreased glutathione levels. Intracellularly, PDK4 can interact with proteins with death domains such as NF-κB and retain them in the cytoplasm [88]. According to the IPA database, three miRNAs, miR-7150, miR-1909-3p, and miR-6868-5p, target SIGIRR [6], which is a downstream regulator of TNF-α, IL-1β, TRIM1 and NF-κB signalling pathways. SIGIRR blocks IL-1R and TLR signalling by interacting with interleukin-1 receptor-associated kinase 1(IRAK-1), a protein linked with the interleukin-1 receptor, and TNF receptor-associated factor 6 (TRAF-6) [89]. Overexpression of SIGIRR reduced TLR-induced production of IL-10, TNF-α, and IFN-γ-induced protein 10 (IP-10) in DCs and HMDMs. Mice lacking SIGIRR experienced more severe collagen-induced arthritis (CIA) [89]. The suppression of naturally produced cytokines was caused by overexpression of SIGIRR in human RA synoviocytes [89]. MT-ATP6 is essential for mitochondrial function, sirtuin signalling, OXPHOS, and glucocorticoid receptor signalling [6]. Let7s are a family of miRNAs that have been shown to have established anti-atherogenic and anti-inflammatory effects. These effects include the control of smooth muscle cells and vascular endothelial cells, both of which are crucial for the emergence of atherosclerosis [74,75]. VSMC migration and proliferation is influenced by Let7 negative feedback control [74].
9. Discussion and Conclusions
Studies indicate that PNLA has potential benefits as a dietary supplement or complementary therapy for chronic inflammatory and immune diseases as well as metabolic disorders. Anti-inflammatory and lipid-lowering drugs (e.g., immunosuppressives, fibrates, statins, bile acid sequestrants, etc.) reduce disease symptoms and reduce lipid levels through various mechanisms but often have adverse side effects. Additionally, considerable residual activity for the disease is often associated with such drugs. Therefore, additional research and clinical trials are required to reinforce PNLA’s anti-inflammatory effects to be included in medical treatment for patients. For example, studies on the role of PNLA on atherosclerosis could include mouse models of the disease or associated risk factors [90,91,92]. Some of the differences in findings on PNLA in the literature could represent different sensitivities of various cell types to the FA, or they could be a result of variation in experimental designs (e.g., inflammatory stimulant, FA concentration, incubation time). However, when considered collectively, current research and older studies show that PNLA may be capable of reducing the production of a plethora of pro-inflammatory cytokines, and oxidative mediators [5,19,27]. Data suggest that PNO and PNLA lower plasma lipids, including both cholesterol and TAG [2,67]. Pine nuts also include a variety of non-PNLA compounds that may have anti-inflammatory and metabolic effects. More research is needed to explore their potential. The unique UPIFA structure in PNLA might prevent it or its major metabolite (ETA) from being metabolised into PGE2. The latter at a lower concentration may reduce COX-2 expression, which as a result decreases the production of MMP in colon cancer cells [93], which further supports the anti-inflammatory effect of PNLA. PGE2 leads to inflammatory pain, and the reduction of PGE2 was also confirmed by Takala et al. in samples from HCs and RA patients [5].
In HepG2 cells and mouse livers, PNLA and pine nuts regulate lipoprotein uptake and reduce the expression of genes involved in FA biosynthesis [25,67]. Furthermore, PNO has several actions that lead to enhanced energy expenditure by increased oxidative metabolism via brown adipose tissue thermogenesis and decreased appetite through increased production of anti-satiety hormones. Reduced adipose tissue deposition, weight gain, and ectopic fat deposition all could result from these effects. Accordingly, PNO increased the expression of genes related to FA oxidation, mitochondrial oxidation, and oxidative metabolism in skeletal muscle [4]. This may explain the ability of PNO and PNLA to regulate muscle and cellular OXPHOS and metabolism.
There is little research on humans because many of the experiments covered in this review were carried out on cell lines or in animal models. Additionally, studies have been of short duration, so the long-term impact has not been established. High-quality clinical trials in humans for both PNO and PNLA will be necessary to establish the optimal doses and their effects on health and diseases. In addition, a well-known, important gut hormone glucagon-like peptide-1 (GLP-1) controls appetites, body weight, and glucose metabolism, which are controlled by PNO and PNLA. It is therefore important to determine whether formulation such as hydrolysed PNO in slow-release capsules may have additional positive impacts specifically in individuals with prediabetes or overt 2DM, in well-powered short- and long-term trials.
10. Prospects and Future Directions
Even though PNLA has biological activity, not all PNO’s effects might be attributable to it. As previously mentioned, pine nuts and PNO include a variety of additional, frequently at modest levels, molecules with potential biological activity, such as phytosterols, tocopherols, and squalene. It will be crucial to distinguish the effects of PNLA from those of the other components of PNO and not to ignore the potential contribution of these components to any biological effect identified for PNO. To assess their potential more accurately, it will be fundamental and worthwhile to examine how this FA affects the metabolism and mediates its anti-inflammatory effects. One such aspect is the lack of evaluation of PNLA’s effects on synovial histology and radiographic progression, as well as their function in early arthritis and their interaction with biologic medications.
Acknowledgments
We thank all authors for their contributions to the article.
Abbreviations
2DM, type 2 diabetes; AA, arachidonic acid; ACAA2, acetyl-CoA acyltransferase 2; ACADL, acyl-CoA dehydrogenase long chain; ACADM, acyl-CoA dehydrogenase medium chain; ACSLs, long chain acyl coenzyme A synthases; AGO2, argonoute 2; ALA, α-linolenic acid; ALP, alkaline phosphatase; ALT, alanine transferase; Apo, Apolipoprotein; AP-1, activator protein-1; ARNT2, aryl hydrocarbon receptor nuclear translocator 2; AST, aspartate transferase; ATGL, adipose triglyceride lipase; CCR2, chemokine receptor 2; CCK, cholecystokinin; CLA, conjugated linoleic acid; COX, cyclooxygenase; CPT, carnitine palmitoyl transferase; CR, caloric restriction; CV, cardiovascular; CVD, cardiovascular disease; DAP3, death associated protein-3; DGLA, dihomo-γ-linolenic acid; DC, dendritic cells; DHA, docosahexaenoic acid; 2DM: type 2 diabetes mellites; ELOVL5, elongase of very-long fatty acid 5; EPA, eicosapentaenoic acid; EPO, evening primrose oil; ETA, eicosatrienoic acid (all cis-7,-11,-14 20:3); ETFA, electron transport flavoprotein subunit alpha; FBP1, fructose bisphosphatase 1; FA, fatty acid; FFA, free fatty acid; FAS, fatty acid synthase; FLCN, ficolin; FSO, flaxseed oil; GLA, γ-linolenic acid; GHRL, ghrelin and obestatin prepropeptide; GLP, glucagon like peptide; GSH-Px, phospholipid hydroperoxide glutathione peroxidase; HC, healthy controls; HFD, high fat diet; HIF-1, hypoxia-inducible factor-1; HMDM, human monocyte-derived macrophages; HMGCR, 3-hydroxy-3-methyl-glutaryl-coenzyme A reductase; HO-1, heme oxygenase-1; ICAM-1, intercellular adhesion molecule-1; IFN, interferon; Ig, immunoglobulin; IL, interleukin; iNOS, inducible nitric oxide synthase; IP-10, IFN-γ-induced protein 10; IPA, Ingenuity Pathway Analysis; IRAK, interleukin-1 receptor associated kinase-1; JAK, Janus kinase; JMJD7-PLA2G4B, Jumonji domain containing 7-phospholipase A2; JNK, c-Jun N-terminal kinase; KEAP1, Kelch-like ECH-associated protein 1; KPN, Korean pine nuts; KLF15, Kruppel-like factor 15; LA, linoleic acid; LCACAD, long chain acyl coenzyme A dehydrogenase; LDH, lactate dehydrogenase; LDL, low-density lipoprotein; LDLr, low density lipoprotein receptor; LPL, lipoprotein lipase; LPS, lipopolysaccharide; LTB4, leukotriene B4; LY, Lucifer Yellow; MAPK, Mitogen activated protein kinase; MCP, monocyte chemotactic protein; MDA, malondialdehyde; MMP, matrix metalloproteinase; MPSO, maritime pine oil; MT-ATP6, mitochondrial-ATP-6; MUFA, monounsaturated fatty acids; ND, normal diet; NDRG2, N-Myc downstream regulator 2; NEFA, Non-esterified fatty acid; NF-κB, nuclear factor kappa- light-chain-enhancer of activated B cells; NMIFA, non-methylene-interrupted fatty acid; NO, nitric oxide; NRF2, nuclear factor erythroid 2-related factor 2; ox-LDL, oxidized low-density lipoprotein; OXPHOS, oxidative phosphorylation; PAI-1, plasminogen activator inhibitor-1; PBMC, peripheral blood mononuclear cells; PDK4, pyruvate dehydrogenase kinase-4; PG, prostaglandin; PGC-1α, Peroxisome proliferator-activated receptor-γ coactivator-1α; PHFD, pine high fat diet; PL, phospholipids; PNLA, pinolenic acid; PNO, pine nuts oil; PPAR, peroxisome proliferator activated receptor; PPINs protein-protein interaction networks; PSO, pine seed oil; PUFA, polyunsaturated fatty acid; RA, rheumatoid arthritis; RANTES, regulated upon activation normal T cell expressed and secreted; ROS, reactive oxygen species; SAO, safflower oil; SBO, soybean oil; SCD1, stearoyl-CoA desaturase 1; SERPINE-1, serpin family E member 1; SOD, superoxide dismutase; SFAs, saturated fatty acids; SHFD, soybean high fat diet; SIGRR, single-immunoglobulin interleukin-1 receptor-related molecule; sICAM-1, soluble intercellular cell adhesion molecule-1; SIRT, Sirtuin; SPN, Siberian pine nuts; SREBP1, Sterol regulatory element-binding protein 1; STAT, Signal transducer and activator of transcription; TAG, triacylglycerol; TFE3, transcription factor E3; TNF, Tumour necrosis factor; tPA, tissue plasminogen activator; TPA, 12-O-tetradecanoylphorbol-13-acetate; TRAF6, TNF receptor-associated factor 6; UCP3, uncoupling protein 3; UFA, unsaturated fatty acid; UPIFA, Δ5-unsaturated polymethylene-interrupted FA; UPA, Uro-plasminogen activator; VLDL, Very low density lipoprotein; VSMC, Vascular smooth muscle cells.
Author Contributions
R.T. conceived the idea for this initiative. R.T. contributed to reading the literature, preparation of figures and tables, and writing—original draft preparation. D.P.R. and E.C. assisted with writing, reviewing, and editing. All authors have read and agreed to the published version of the manuscript.
Institutional Review Board Statement
Not applicable.
Informed Consent Statement
Not applicable.
Data Availability Statement
Not applicable.
Conflicts of Interest
The authors declare no conflict of interest.
Funding Statement
This research received no external funding.
Footnotes
Disclaimer/Publisher’s Note: The statements, opinions and data contained in all publications are solely those of the individual author(s) and contributor(s) and not of MDPI and/or the editor(s). MDPI and/or the editor(s) disclaim responsibility for any injury to people or property resulting from any ideas, methods, instructions or products referred to in the content.
References
- 1.Calder P.C. Marine omega-3 fatty acids and inflammatory processes: Effects, mechanisms and clinical relevance. Biochim. Biophys. Acta. 2015;1851:469–484. doi: 10.1016/j.bbalip.2014.08.010. [DOI] [PubMed] [Google Scholar]
- 2.Pasman W.J., Heimerikx J., Rubingh C.M., van den Berg R., O’Shea M., Gambelli L., Hendriks H.F., Einerhand A.W., Scott C., Keizer H.G., et al. The effect of Korean pine nut oil on in vitro CCK release, on appetite sensations and on gut hormones in post-menopausal overweight women. Lipids Health Dis. 2008;7:10. doi: 10.1186/1476-511X-7-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Xie K., Miles E.A., Calder P.C. A review of the potential health benefits of pine nut oil and its characteristic fatty acid pinolenic acid. J. Funct. Foods. 2016;23:464–473. doi: 10.1016/j.jff.2016.03.003. [DOI] [Google Scholar]
- 4.Le N.H., Shin S., Tu T.H., Kim C.-S., Kang J.-H., Tsuyoshi G., Teruo K., Han S.N., Yu R. Diet enriched with Korean pine nut oil improves mitochondrial oxidative metabolism in skeletal muscle and brown adipose tissue in diet-induced obesity. J. Agric. Food Chem. 2012;60:11935–11941. doi: 10.1021/jf303548k. [DOI] [PubMed] [Google Scholar]
- 5.Takala R., Ramji D.P., Andrews R., Zhou Y., Burston J., Choy E. Anti-inflammatory and immunoregulatory effects of pinolenic acid in rheumatoid arthritis. Rheumatology. 2021;61:992–1004. doi: 10.1093/rheumatology/keab467. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Takala R., Ramji D.P., Andrews R., Zhou Y., Farhat M., Elmajee M., Rundle S., Choy E. Pinolenic acid exhibits anti-inflammatory and anti-atherogenic effects in peripheral blood-derived monocytes from patients with rheumatoid arthritis. Sci. Rep. 2022;12:8807. doi: 10.1038/s41598-022-12763-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Amr A.R., Abeer E.E.K. Hypolipideimic and hypocholestermic effect of pinenuts in rats fed high fat, cholesterol-diet. World Appl. Sci. J. 2011;15:1677. [Google Scholar]
- 8.Lee A.R., Han S.N. Pinolenic acid downregulates lipid anabolic pathway in HepG2 Cells. Lipids. 2016;51:847–855. doi: 10.1007/s11745-016-4149-6. [DOI] [PubMed] [Google Scholar]
- 9.Destaillats F., Cruz-Hernandez C., Giuffrida F., Dionisi F. Identification of the botanical origin of pine nuts found in food products by gas−liquid chromatography analysis of fatty acid profile. J. Agric. Food Chem. 2010;58:2082–2087. doi: 10.1021/jf9041722. [DOI] [PubMed] [Google Scholar]
- 10.Kang Y.H., Kim K.K., Kim T.W., Choe M. Anti-atherosclerosis effect of pine nut oil in high-cholesterol and high-fat diet fed rats and its mechanism studies in human umbilical vein endothelial cells. Food Sci. Biotechnol. 2015;24:323–332. doi: 10.1007/s10068-015-0043-x. [DOI] [Google Scholar]
- 11.Park Y.S., Chung M.S. Cholesterol-lowering effect of pine nut in plasma of rats. Korean J. Food Sci. Technol. 2005;37:702–708. [Google Scholar]
- 12.Ryan E., Galvin K., O’Connor T.P., Maguire A., O’Brien N.M. Fatty acid profile, tocopherol, squalene and phytosterol content of brazil, pecan, pine, pistachio and cashew nuts. Int. J. Food Sci. Nutr. 2006;57:219–228. doi: 10.1080/09637480600768077. [DOI] [PubMed] [Google Scholar]
- 13.Zadernowski R., Naczk M., Czaplicki S. Chemical composition of Pinus sibirica nut oils. Eur. J. Lipid Sci. Technol. 2009;111:698–704. doi: 10.1002/ejlt.200800221. [DOI] [Google Scholar]
- 14.Matthäus B., Li P., Ma F., Zhou H., Jiang J., Özcan M.M. Is the profile of fatty acids, tocopherols, and amino acids suitable to differentiate Pinus armandii suspicious to be responsible for the pine nut syndrome from other pinus species? Chem. Biodivers. 2018;15:e1700323. doi: 10.1002/cbdv.201700323. [DOI] [PubMed] [Google Scholar]
- 15.Tanaka T., Takimoto T., Morishige J.-I., Kikuta Y., Sugiura T., Satouchi K. Non-methylene-interrupted polyunsaturated fatty acids: Effective substitute for arachidonate of phosphatidylinositol. Biochem. Biophys. Res. Commun. 1999;264:683–688. doi: 10.1006/bbrc.1999.1559. [DOI] [PubMed] [Google Scholar]
- 16.Chuang L.-T., Tsai P.-J., Lee C.-L., Huang Y.-S. Uptake and Incorporation of pinolenic acid reduces n-6 polyunsaturated fatty acid and downstream prostaglandin formation in murine macrophage. Lipids. 2009;44:217–224. doi: 10.1007/s11745-008-3276-0. [DOI] [PubMed] [Google Scholar]
- 17.Chen S.-J., Chuang L.-T., Liao J.-S., Huang W.-C., Lin H.-H. Phospholipid incorporation of non-methylene-interrupted fatty acids (NMIFA) in murine microglial BV-2 cells reduces pro-inflammatory mediator production. Inflammation. 2015;38:2133–2145. doi: 10.1007/s10753-015-0196-z. [DOI] [PubMed] [Google Scholar]
- 18.Tanaka T., Hattori T., Kouchi M., Hirano K., Satouchi K. Methylene-interrupted double bond in polyunsaturated fatty acid is an essential structure for metabolism by the fatty acid chain elongation system of rat liver. Biochim. Biophys. Acta. 1998;1393:299–306. doi: 10.1016/S0005-2760(98)00084-8. [DOI] [PubMed] [Google Scholar]
- 19.Chen S.J., Huang W.C., Shen H.J., Chen R.Y., Chang H., Ho Y.S., Tsai P.J., Chuang L.T. Investigation of modulatory effect of pinolenic acid (PNA) on inflammatory responses in human THP-1 macrophage-like cell and mouse models. Inflammation. 2020;43:518–531. doi: 10.1007/s10753-019-01134-7. [DOI] [PubMed] [Google Scholar]
- 20.Baker E.J., Valenzuela C.A., De Souza C.O., Yaqoob P., Miles E., Calder P.C. Comparative anti-inflammatory effects of plant- and marine-derived omega-3 fatty acids explored in an endothelial cell line. Biochim. Biophys. Acta. 2020;1865:158662. doi: 10.1016/j.bbalip.2020.158662. [DOI] [PubMed] [Google Scholar]
- 21.Baker E.J., Yusof M.H., Yaqoob P., Miles E.A., Calder P.C. Omega-3 fatty acids and leukocyte-endothelium adhesion: Novel anti-atherosclerotic actions. Mol. Asp. Med. 2018;64:169–181. doi: 10.1016/j.mam.2018.08.002. [DOI] [PubMed] [Google Scholar]
- 22.Chen S.-J., Hsu C.-P., Li C.-W., Lu J.-H., Chuang L.-T. Pinolenic acid inhibits human breast cancer MDA-MB-231 cell metastasis in vitro. Food Chem. 2011;126:1708–1715. doi: 10.1016/j.foodchem.2010.12.064. [DOI] [PubMed] [Google Scholar]
- 23.Tanaka T., Morishige J.I., Iwawaki D., Fukuhara T., Hamamura N., Hirano K., Osumi T., Satouchi K. Metabolic pathway that produces essential fatty acids from polymethylene-interrupted polyunsaturated fatty acids in animal cells. FEBS J. 2007;274:2728–2737. doi: 10.1111/j.1742-4658.2007.05807.x. [DOI] [PubMed] [Google Scholar]
- 24.Shikov A.N., Pozharitskaya O.N., Makarov V.G., Makarova M.N. Anti-inflammatory effect of Pinus sibirica oil extract in animal models. J. Nat. Med. 2008;62:436–440. doi: 10.1007/s11418-008-0254-z. [DOI] [PubMed] [Google Scholar]
- 25.Zhang J., Zhang S.D., Wang P., Guo N., Wang W., Yao L.P., Yang Q., Efferth T., Jiao J., Fu Y.J. Pinolenic acid ameliorates oleic acid-induced lipogenesis and oxidative stress via AMPK/SIRT1 signaling pathway in HepG2 cells. Eur. J. Pharm. 2019;861:172618. doi: 10.1016/j.ejphar.2019.172618. [DOI] [PubMed] [Google Scholar]
- 26.Calder P.C. Omega-3 fatty acids and inflammatory processes: From molecules to man. Biochem. Soc. Trans. 2017;45:1105–1115. doi: 10.1042/BST20160474. [DOI] [PubMed] [Google Scholar]
- 27.Baker E.J., Miles E.A., Calder P.C. A review of the functional effects of pine nut oil, pinolenic acid and its derivative eicosatrienoic acid and their potential health benefits. Prog. Lipid Res. 2021;82:101097. doi: 10.1016/j.plipres.2021.101097. [DOI] [PubMed] [Google Scholar]
- 28.Calder P.C. The role of marine omega-3 (n-3) fatty acids in inflammatory processes, atherosclerosis, and plaque stability. Mol. Nutr. Food Res. 2012;56:1073–1080. doi: 10.1002/mnfr.201100710. [DOI] [PubMed] [Google Scholar]
- 29.Huang W.C., Tsai P.J., Huang Y.L., Chen S.N., Chuang L.T. PGE2 production is suppressed by chemically synthesized Delta7-eicosatrienoic acid in macrophages through the competitive inhibition of COX-2. Food Chem. Toxicol. 2014;66:122–133. doi: 10.1016/j.fct.2014.01.031. [DOI] [PubMed] [Google Scholar]
- 30.Matsuo N., Osada K., Kodama T., Lim B.O., Nakao A., Yamada K. Effects of gamma-linolenic acid and its positional isomer pinolenic acid on immune parameters of brown-Norway rats. Prostagland Leukot. Essent. Fat. Acids. 1996;55:223–229. doi: 10.1016/S0952-3278(96)90002-2. [DOI] [PubMed] [Google Scholar]
- 31.Park S., Lim Y., Shin S., Han S.N. Impact of Korean pine nut oil on weight gain and immune responses in high-fat diet-induced obese mice. Nutr. Res. Pract. 2013;7:352–358. doi: 10.4162/nrp.2013.7.5.352. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Lin C.-Y., Wang W.-H., Chen S.-H., Chang Y.-W., Hung L.-C., Chen C.-Y., Chen Y.-H. Lipopolysaccharide-induced nitric oxide, prostaglandin E2, and cytokine production of mouse and human macrophages are suppressed by pheophytin-b. Int. J. Mol. Sci. 2017;18:2637. doi: 10.3390/ijms18122637. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Poljsak B., Milisav I. The neglected significance of “antioxidative stress”. Oxid. Med. Cell. 2012;2012:480895. doi: 10.1155/2012/480895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Chen X., Zhang Y., Wang Z., Zu Y. In vivo antioxidant activity of Pinus koraiensis nut oil obtained by optimised supercritical carbon dioxide extraction. Nat. Prod. Res. 2011;25:1807–1816. doi: 10.1080/14786419.2010.483229. [DOI] [PubMed] [Google Scholar]
- 35.Zhao Y., Liu S., Sheng Z., Li X., Chang Y., Dai W., Chang S.K., Liu J., Yang Y. Effect of pinolenic acid on oxidative stress injury in HepG2 cells induced by H2O2. Food Sci. Nutr. 2021;9:5689–5697. doi: 10.1002/fsn3.2534. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Lever J.M., Boddu R., George J.F., Agarwal A. Heme oxygenase-1 in kidney health and disease. Antioxid. Redox Signal. 2016;25:165–183. doi: 10.1089/ars.2016.6659. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Long X., Song J., Zhao X., Zhang Y., Wang H., Liu X., Suo H. Silkworm pupa oil attenuates acetaminophen-induced acute liver injury by inhibiting oxidative stress-mediated NF-κB signaling. Food Sci. Nutr. 2020;8:237–245. doi: 10.1002/fsn3.1296. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Yuemin W., Yanlei X., Aiping Z., Nannan Z., Jiashen Z., Dongmei Z., Zhenhai Y., Ning X., Yancun Y., Xiying L., et al. Oligosaccharide attenuates ageing-related liver dysfunction by activating Nrf2 antioxidant signaling. Food Sci. Nutr. 2020;8:3872–3881. doi: 10.1002/fsn3.1681. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Li R.L., He L.Y., Zhang Q., Liu J., Lu F., Duan H.X.Y., Fan L.H., Peng W., Huang Y.L., Wu C.J. HIF-1α is a potential molecular target for herbal medicine to treat diseases. Drug Des. Dev. Ther. 2020;14:4915. doi: 10.2147/DDDT.S274980. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Marcelin G., Silveira A.L.M., Martins L.B., Ferreira A.V., Clément K. Deciphering the cellular interplays underlying obesity-induced adipose tissue fibrosis. J. Clin. Invest. 2019;129:4032–4040. doi: 10.1172/JCI129192. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Blüher M. Obesity: Global epidemiology and pathogenesis. Nat. Rev. Endocrinol. 2019;15:288–298. doi: 10.1038/s41574-019-0176-8. [DOI] [PubMed] [Google Scholar]
- 42.Climent E., Pérez-Calahorra S., Marco-Benedí V., Plana N., Sánchez R., Ros E., Ascaso J.F., Puzo J., Almagro F., Lahoz C., et al. Effect of LDL cholesterol, statins and presence of mutations on the prevalence of type 2 diabetes in heterozygous familial hypercholesterolemia. Sci. Rep. 2017;7:5596. doi: 10.1038/s41598-017-06101-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Defesche J.C., Gidding S.S., Harada-Shiba M., Hegele R.A., Santos R.D., Wierzbicki A.S. Familial hypercholesterolaemia. Nat. Rev. Dis. Primers. 2017;3:17093. doi: 10.1038/nrdp.2017.93. [DOI] [PubMed] [Google Scholar]
- 44.Sugano M., Ikeda I., Wakamatsu K., Oka T. Influence of Korean pine (Pinus koraiensis)-seed oil containing cis-5, cis-9, cis-12-octadecatrienoic acid on polyunsaturated fatty acid metabolism, eicosanoid production and blood pressure. Br. J. Nutr. 1994;72:775–783. doi: 10.1079/BJN19940079. [DOI] [PubMed] [Google Scholar]
- 45.Asset G., Bauge E., Wolff R.L., Fruchart J.-C., Dallongeville J. Effects of dietary maritime pine seed oil on lipoprotein metabolism and atherosclerosis development in mice expressing human apolipoprotein B. Eur. J. Nutr. 2001;40:268–274. doi: 10.1007/s394-001-8355-6. [DOI] [PubMed] [Google Scholar]
- 46.Jin S.C., Kim M.H., Nam Y.K., Yang W.M. Fat regulatory mechanisms of pine nut oil based on protein interaction network analysis. Phytomedicine. 2021;86:153557. doi: 10.1016/j.phymed.2021.153557. [DOI] [PubMed] [Google Scholar]
- 47.No D.S., Kim I.-H. Pinolenic acid as a new source of phyto-polyunsaturated fatty acid. Lipid Technol. 2013;25:135–138. doi: 10.1002/lite.201300278. [DOI] [Google Scholar]
- 48.Lee J.W., Lee K.W., Lee S.W., Kim I.H., Rhee C. Selective increase in pinolenic acid (all-cis-5,9,12-18:3) in Korean pine nut oil by crystallization and its effect on LDL-receptor activity. Lipids. 2004;39:383–387. doi: 10.1007/s11745-004-1242-2. [DOI] [PubMed] [Google Scholar]
- 49.Park S., Shin S., Lim Y., Shin J.H., Seong J.K., Han S.N. Korean pine nut oil attenuated hepatic triacylglycerol accumulation in high-fat diet-induced obese mice. Nutrients. 2016;8:59. doi: 10.3390/nu8010059. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Ferramosca A., Savy V., Einerhand A., Zara V. Pinus koraiensis seed oil (PinnoThinTM) supplementation reduces body weight gain and lipid concentration in liver and plasma of mice. J. Anim. Feed Sci. 2008;17:621–630. doi: 10.22358/jafs/66690/2008. [DOI] [Google Scholar]
- 51.Ferramosca A., Savy V., Conte L., Zara V. Dietary combination of conjugated linoleic acid (CLA) and pine nut oil prevents CLA-induced fatty liver in mice. J. Agric. Food Chem. 2008;56:8148–8158. doi: 10.1021/jf8010728. [DOI] [PubMed] [Google Scholar]
- 52.Jiang C., Ting A.T., Seed B. PPAR-γ agonists inhibit the production of monocyte inflammatory cytokines. Nature. 1998;391:82–86. doi: 10.1038/34184. [DOI] [PubMed] [Google Scholar]
- 53.Su C.G., Wen X., Bailey S.T., Jiang W., Rangwala S.M., Keilbaugh S.A., Flanigan A., Murthy S., Lazar M.A., Wu G.D. Nová liečba kolitídy využívajúca ligandy PPAR-γ na inhibíciu epiteliálnej zápalovej reakcie. J. Clin. Investovať. 1999; 104:383–389. DOI: 10.1172/JCI7145. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 54.Merecz-Sadowska A., Sitarek P., Sliwinski T., Zajdel R. Protizápalová aktivita extraktov a čistých zlúčenín získaných z rastlín prostredníctvom modulácie signálnych dráh, najmä PI3K/AKT v makrofágoch. Int. J. Mol. Sci. 2020;21:9605. doi: 10.3390/ijms21249605. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 55.Ivanova E.A., Myasoedova V.A., Melnichenko A.A., Orekhov A.N. Gama agonisti receptora aktivovaného peroxizómom (PPAR) ako terapeutické látky pri kardiovaskulárnych poruchách: Zamerajte sa na aterosklerózu. Curr. Pharm. Des. 2017; 23:1119–1124. DOI: 10.2174/1381612823666161118145850. [DOI] [PubMed] [Google Scholar]
- 56.Wagner N., Wagner K.-D. PPAR a angiogenéza-implikácie v patológii. Int. J. Mol. Sci. 2020;21:5723. DOI: 10.3390/ijms21165723. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 57.Rigamonti E., Chinetti-Gbaguidi G., Staels B. Regulácia makrofágových funkcií pomocou PPAR-α, PPAR-γ a LXR u myší a ľudí. Arterscler. Tromb Vasc. Biol. 2008; 28:1050–1059. doi: 10.1161/ATVBAHA.107.158998. [DOI] [PubMed] [Google Scholar]
- 58.Li AC, Brown KK, Silvestre MJ, Willson TM, Palinski W., Glass CK Receptor γ ligandy aktivované proliferátorom peroxizómu inhibujú rozvoj aterosklerózy u myší s nedostatkom LDL receptora. J. Clin. Investovať. 2000; 106:523–531. DOI: 10.1172/JCI10370. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 59.Young J.M., Shand B.I., McGregor P.M., Scott R.S., Frampton C.M. Porovnávacie účinky a suplementácie vitamínu C v porovnaní so samotným vitamínom C na endotelovú funkciu a biochemické markery oxidačného stresu a zápalu u chronických fajčiarov. Slobodný. Radikál. 2006; 40:85–94. DOI: 10.1080/10715760500329788. [DOI] [PubMed] [Google Scholar]
- 60.Shand B., Strey C., Scott R., Morrison Z., Gieseg S. Pilotná štúdia o klinických účinkoch doplnkov stravy s Enzogenolom, flavonoidovým extraktom z borovicovej kôry a vitamínom C. Phytother. Res. 2003; 17:490–494. DOI: 10.1002/ptr.1181. [DOI] [PubMed] [Google Scholar]
- 61.Christiansen E., Watterson K.R., Stocker C.J., Sokol E., Jenkins L., Simon K., Ulven T. Aktivita mastných kyselín v potrave na FFA1 a FFA4 a charakterizácia kyseliny pinolénovej ako duálneho agonistu FFA1/FFA4 s potenciálnym účinkom proti metabolickým ochoreniam. Br. J. Nutr. 2015; 113:1677–1688. DOI: 10.1017/S000711451500118X. [DOI] [PubMed] [Google Scholar]
- 62.Calder P.C. Funkčné úlohy mastných kyselín a ich účinky na ľudské zdravie. J. Parenter. Enter. Nutr. 2015; 39:18S–32S. doi: 10.1177/0148607115595980. [DOI] [PubMed] [Google Scholar]
- 63.Briscoe CP, Tadayyon M., Andrews J.L., Benson W.G., Chambers J.K., Eilert M.M., Ellis C., Elshourbagy N.A., Goetz A.S., Minnick D.T., et al. Ojedinelý receptor spojený s proteínom G GPR40 je aktivovaný mastnými kyselinami so stredným a dlhým reťazcom. J. Biol. Chem. 2003; 278:11303–11311. DOI: 10.1074/JBC. M211495200. [DOI] [PubMed] [Google Scholar]
- 64.Itoh Y., Kawamata Y., Harada M., Kobayashi M., Fujii R., Fukusumi S., Fujino M. Voľné mastné kyseliny regulujú sekréciu inzulínu z buniek β pankreasu prostredníctvom GPR40. Príroda. 2003; 422:173–176. DOI: 10.1038/nature01478. [DOI] [PubMed] [Google Scholar]
- 65.Talukdar S., Bae E.J., Imamura T., Morinaga H., Fan W., Li P., Lu W.J., Watkins SM, Olefsky JM GPR120 je receptor omega-3 mastných kyselín sprostredkúvajúci silné protizápalové a senzibilizujúce účinky na inzulín. Bunka. 2010; 142:687–698. DOI: 10.1016/j.cell.2010.07.041. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 66.Watterson K.R., Hudson B.D., Ulven T., Milligan G. Liečba cukrovky 2. typu agonistami voľných receptorov mastných kyselín. Predný. Endokrinol. 2014;5:137. DOI: 10.3389/fendo.2014.00137. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 67.Zhu S., Park S., Lim Y., Shin S., Han SN Náhrada kórejského oleja z píniových orieškov znižuje absorpciu črevných lipidov a zároveň zlepšuje metabolizmus pečeňových lipidov u myší. Nutr. Res. Pract. 2016; 10:477–486. DOI: 10.4162/NRP.2016.10.5.477. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 68.Hughes G.M., Boyland E.J., Williams N.J., Mennen L., Scott C., Kirkham T.C., Harrold J.A., Keizer H.G., Halford J.C. Účinok kórejského oleja z píniových orieškov (PinnoThin™) na príjem potravy, správanie pri kŕmení a chuť do jedla: Dvojito zaslepená placebom kontrolovaná štúdia. Lipidy Health Dis. 2008;7:10. doi: 10.1186/1476-511X-7-6. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 69.František Z., Meuselbach K. Účinok oleja zo semien Pinus koraiensis na hormóny sýtosti CCK a GLP-1 a potlačenie chuti do jedla. Transl Biomed. 2010;1:5. [Google Scholar]
- 70.Chung M., Kim J., Choi H., Choi H., Noh S.K., Kim B.H. Štruktúrovaný olej z píniových orieškov má hypocholesterolemickú aktivitu zvýšením expresie génu LDLR v pečeni obéznych myší. Eur. J. Lipid Sci. Technol. 2019;121:1900049. DOI: 10.1002/ejlt.201900049. [DOI] [Google Scholar]
- 71.Liu B., Xu L., Yu X., Li W., Sun X., Xiao S., Wang H. Ochranný účinok KLF15 na vaskulárnu endoteliálnu dysfunkciu vyvolanú TNF α. Mol. Med. Rep. 2018; 18:1987–1994. DOI: 10.3892/MMR.2018.9195. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 72.Lu Y., Zhang L., Liao X., Sangwung P., Prosdocimo DA, Zhou G., Votruba AR, Brian L., Han YJ, Gao H. a kol. Kruppelov faktor 15 je rozhodujúci pre vaskulárny zápal. J. Clin. Vyšetrovanie. 2013; 123:4232–4241. DOI: 10.1172/JCI68552. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 73.Furer V., Greenberg J.D., Attur M., Abramson S., Pillinger M.H. Úloha mikroRNA pri reumatoidnej artritíde a iných autoimunitných ochoreniach. Clin Immunol. 2010; 136:1–15. DOI: 10.1016/j.clim.2010.02.005. [DOI] [PubMed] [Google Scholar]
- 74.Chen K.-C., Juo S.-H.H. MikroRNA pri ateroskleróze. Kaohsiung J. Med. Sci. 2010; 28:631–640. DOI: 10.1016/j.kjms.2012.04.001. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 75.Brennan E., Wang B., McClelland A., Mohan M., Marai M., Beuscart O., Derouiche S., Gray S., Pickering R., Tikellis C., et al. Ochranný účinok rodiny let-7miRNA pri regulácii zápalu pri ateroskleróze spojenej s cukrovkou. Cukrovka. 2017; 66:2266–2277. DOI: 10.2337/DB16-1405. [DOI] [PubMed] [Google Scholar]
- 76.Pastore N., Brady O.A., Diab H.I., Martina J.A., Sun L., Huynh T., Lim J.A., Zare H., Raben N., Ballabio A., et al. TFEB a TFE3 spolupracujú pri regulácii vrodenej imunitnej odpovede v aktivovaných makrofágoch. Autofágia. 2016; 12:1240–1258. DOI: 10.1080/15548627.2016.1179405. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 77.Kim H.R., Chae H.J., Thomas M., Miyazaki T., Monosov A., Monosov E., Krajewska M., Krajewski S., Reed J.C. Ccavčí dap3 je základný gén potrebný pre mitochondriálnu homeostázu in vivo a prispieva k vonkajšej dráhe apoptózy. FASEB J. 2007; 21:188–196. DOI: 10.1096/fj.06-6283com. [DOI] [PubMed] [Google Scholar]
- 78.Busso N., Peclat V., So A., Sappino A.-P. Aktivácia plazminogénu v synoviálnych tkanivách: Rozdiely medzi normálnymi kĺbmi, kĺbmi s osteoartrózou a reumatoidnou artritídou. Ann. Rheumová. Dis. 1997; 56:550–557. DOI: 10.1136/ard.56.9.550. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 79.Raghu H., Jone A., Cruz C., Rewerts CL, Frederick MD, Thornton S., Degen JL, Flick MJ Plasminogen je kĺbovo špecifický pozitívny alebo negatívny determinant patogenézy artritídy u myší. Artritída reumatol. 2014; 66:1504–1516. DOI: 10.1002/art.38402. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 80.Veras F.P., Peres R.S., Saraiva A.L., Pinto L.G., Louzada-Junior P., Cunha TM, Alves-Filho J.C. Fruktóza 1, 6-bisfosfát, vysokoenergetický medziprodukt glykolýzy, tlmí experimentálnu artritídu aktiváciou protizápalovej adenosinergnej dráhy. Sci. Rep. 2015;5:15171. doi: 10.1038/srep15171. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 81.Patterson E., Wall R., Fitzgerald G.F., Ross R.P., Stanton C. Zdravotné dôsledky vysokého obsahu omega-6 polynenasýtených mastných kyselín v strave. J. Nutr. Metab. 2011;2012:539426. DOI: 10.1155/2012/539426. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 82.Sosnowska B., Mazidi M., Penson P., Gluba-Brzózka A., Rysz J., Banach M. Členovia rodiny sirtuínov SIRT1, SIRT3 a SIRT6: Ich úloha vo vaskulárnej biológii a aterogenéze. Ateroskleróza. 2017; 265:275–282. DOI: 10.1016/j.ateroskleróza.2017.08.027. [DOI] [PubMed] [Google Scholar]
- 83.Wang Z., Li Y., Wang Y., Zhao K., Chi Y., Wang B. Pyrrolochinolínchinín chráni bunky HK-2 pred oxidačným stresom a apoptózou vyvolaným vysokou glukózou prostredníctvom signálnej dráhy Sirt3 a PI3K/Akt/FoxO3a. Biochémia. Biofyzika. Res. Commun. 2019; 508:398–404. DOI: 10.1016/j.bbrc.2018.11.140. [DOI] [PubMed] [Google Scholar]
- 84.Yeung F., Hoberg J.E., Ramsey CS, Keller M.D., Jones D.R., Frye RA, Mayo M.W. Modulácia transkripcie závislej od NF-κB a prežitie buniek deacetylázou SIRT1. EMBO J. 2004; 23:2369–2380. DOI: 10.1038/sj.emboj.7600244. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 85.Kong S., Yeung P., Fang D. Histondeacetyláza sirtuín 1 triedy III pri imunosupresii a jej terapeutický potenciál pri reumatoidnej artritíde. J. Genet. Genóm. 2013; 40:347–354. DOI: 10.1016/j.jgg.2013.04.001. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 86.Qiu Y., Zhou X., Liu Y., Tan S., Li Y. Úloha sirtuínu-1 v imunitnej odpovedi a systémovom lupus erythematosus. Predný. Imunol. 2021;2021:632383. DOI: 10.3389/FIMMU.2021.632383. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 87.Niederer F., Ospelt C., Brentano F., Hottiger M.O., Gay R.E., Gay S., Detmar M., Kyburz D. Nadmerná expresia SIRT1 v synovii reumatoidnej artritídy prispieva k produkcii prozápalových cytokínov a rezistencii na apoptózu. Ann. Rheum. Dis. 2011;70:1866. doi: 10.1136/ard.2010.148957. [DOI] [PubMed] [Google Scholar]
- 88.Dlamini Z., Ntlabati P., Mbita Z., Shoba-Zikhali L. Pyruvátdehydrogenázová kináza 4 (PDK4) by sa mohla podieľať na regulačnej úlohe pri apoptóze a súvislosti medzi apoptózou a inzulínovou rezistenciou. Exp. Mol. Pathol. 2015; 98:574–584. DOI: 10.1016/j.yexmp.2015.03.022. [DOI] [PubMed] [Google Scholar]
- 89.Drexler S.K., Kong P., Inglis J., Williams R.O., Garlanda C., Mantovani A., Yazdi AS, Brennan F., Feldmann M., Foxwell BM SIGIRR/TIR-8 je inhibítor signalizácie receptorov podobných mýtu v primárnych ľudských bunkách a reguluje zápal v modeloch reumatoidnej artritídy. artritída Rheum. 2010; 62:2249–2261. DOI: 10.1002/art.27517. [DOI] [PubMed] [Google Scholar]
- 90.Al-Ahmadi W., Webberley TS, Joseph A., Harris F., Chan Y., Alotibi R., Williams JO, Alahmadi A., Decker T., Hughes TR a kol. Pro-aterogénne účinky prevodníka signálu a aktivátora fosforylácie serínu 727 transkripcie 1 u myší s nedostatkom LDL receptora prostredníctvom modulácie zápalu plaku. FASEB J. 2021; 35:E21892. doi: 10.1096/fj.202100571RR. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 91.O’Morain V.L., Chan Y., Williams J.O., Alotibi R., Alahmadi A., Rodrigues N.P., Plummer S.F., Hughes T.R., Michael D.R., Ramji D.P. Konzorcium probiotík Lab4P tlmí aterosklerózu u myší s nedostatkom LDL receptora kŕmených stravou s vysokým obsahom tukov a spôsobuje stabilizáciu plaku inhibíciou zápalu a niekoľkých pro-aterogénnych procesov. Mol. Nutr. potravinové rez. 2021; 65:e2100214. DOI: 10.1002/MNFR.202100214. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 92.Moss J.W.E., Williams J.O., Al-Ahmadi W., O’Morain V., Chan Y.H., Hughes T.R., Menendez-Gonzalez J.B., Almotiri A., Plummer S.F., Rodrigues N.P., et al. Ochranné účinky jedinečnej kombinácie nutrične aktívnych zložiek na rizikové faktory a génovú expresiu spojenú s aterosklerózou u myší C57BL/6J kŕmených stravou s vysokým obsahom tukov. Funkcia jedla. 2021; 12:3657–3671. DOI: 10.1039/D0FO02867C. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]
- 93.Tsujii M., Kawano S., DuBois RN Expresia cyklooxygenázy-2 v bunkách rakoviny hrubého čreva v ľudských bunkách rakoviny hrubého čreva zvyšuje metastatický potenciál. Proc. Natl. Acad. Sci. USA. 1997; 94:3336–3340. DOI: 10.1073/pnas.94.7.3336. [DOI] [PMC bezplatný článok] [PubMed] [Google Scholar]